Adrenalektomie rechts, offen - Allgemein- und Viszeralchirurgie
Sie haben keine Lizenz erworben - paywall ist aktiv: zur Produktauswahl
Laparatomie; Exploration
Die Laparotomie erfolgt mit einem rechtsseitigen Querschnitt auf Nabelhöhe. Nach Durchtrennung der rechtsseitigen Rektusmuskulatur mittels bipolarer Schere und Eröffnen des Peritoneums wird die Inzision in der Mittellinie bis zum Xiphoid verlängert wird. Untersuchung der Bauchorgane zum Ausschluss weiterer Metastasen, Bestätigung der Resektabilität.
Mobilisation des Duodenums nach Kocher
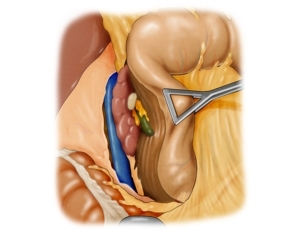
Darstellung des rechten Retroperitoneums mit Mobilisation der Leber
Die rechte Nebenniere steht an ihrer Rückseite mit dem Zwerchfell in Kontakt. Die Unterfläche liegt der Niere an, ventrokranial grenzt sie an die Area nuda der Leber. Medial liegt die Vorderfläche der Nebenniere hinter der Vena cava inferior. Der untere Teil der Vorderseite ist von Peritoneum parietale überzogen, das
zunächst parallel zur unteren Hohlvene eröffnet wird. Das Lig. triangulare dextrum muss durchtennt werden, um anschließend die Leber nach kranial halten zu können. Anschließend werden die Verklebungen zwischen Leberunterfläche und Nebenniere durchtrennt. Durch die peritumoröse entzündliche Reaktion besteht hier inniger Kontakt.Bemerkung: Operative Eingriffe am rechtsseitigen Retroperitoneum sind schwieriger als am linksseitigen, da eine Lebervergrößerung, Adipositas oder ein Fassthorax die Einstellung des Operationssitus sehr erschweren können.
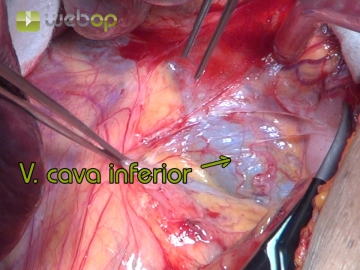
Präparation an der Vena cava inferior
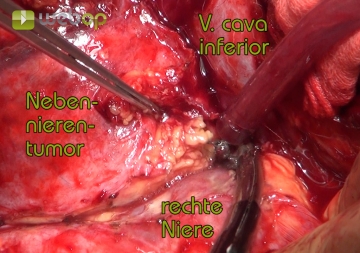
Ablösen der Nebenniere von der Niere
Absetzen der Nebennierenvene
Retrokavale Ablösung des Nebennierentumors
Entnahme des Präparates
Zwerchfellnaht; Verklebung der Leber
Drainage; Bauchdeckenverschluss
Einzelfreischaltung
Freischaltung auf diesen Lehrbeitrag
für 3 Tage
4,99 € inkl. MwSt.

webop-Account Single
Freischaltung aller Lehrbeiträge
Preis pro Monat
für das Modul: Allgemein- und Viszeralchirurgie