Anastomosentechnik, biliodigestiv, nach Hepp-Couinaud - Allgemein- und Viszeralchirurgie
Sie haben keine Lizenz erworben - paywall ist aktiv: zur Produktauswahl
Prinzip
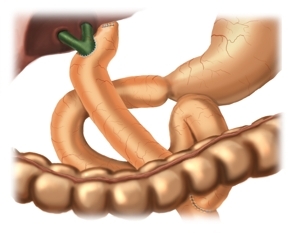
Bei der hoch-hilären Hepatico-Jejunostomie nach Hepp-Couinaud erfolgt die Anastomose der Rouxschen Jejunumschlinge mit dem extrahepatischen Ductus hepaticus sinister Seit-zu-Seit. Diese hohe Form der biliodigestiven Anastomose wählt man bei Stenosen, die bis an die Bifurkation reichen aber erhaltenem Konfluens.
Ansonsten gleicht die Operationstechnik der Anastomosentechnik, biliodigestiv, klassisch.- Es sollte eine möglichst weite Anastomosenöffnung geschaffen werden.
- Die Naht mit einreihig allschichtigen Einzelknopfnahtreihen sollte primär dicht sein.
- Eine exakte Adaptation von Galle- und Darmschleimhaut muss angestrebt werden.
Exploration
Präparation und Durchtrennung des Ductus hepatocholedochus
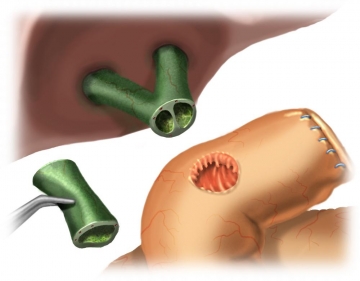
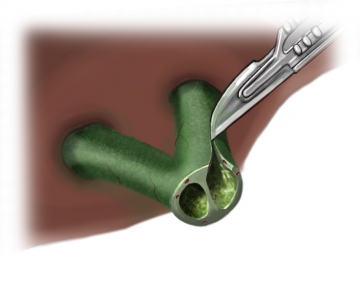
Nach zirkulärer Freipräparation des Gallenganges erfolgt das Absetzen des Ductus hepaticus im Bereich des Leberhilus. Hier lassen sich bereits die beiden Lumina des Ductus hepaticus dextra und sinistra darstellen. Ein Segment des Gallenganges wird entfernt, das duodenalseitige Ende des Ductus choledochus wird mit fortlaufender Naht (Vicryl® 3-0) übernäht (nicht dargestellt). Im Bereich des abgesetzten hilären Gallenganges erfolgt die subtile Blutstillung ggf. mit 6-0 PDS.
Erweiterung des linken Gallenganges nach Hepp-Couinaud
Vorlage der Anastomosenvorderwand
Mobilisation der zweiten Jejunalschlinge in den rechten Oberbauch
Herstellen der Anastomosenhinterwand
Komplettierung der Anastomose
Einzelfreischaltung
Freischaltung auf diesen Lehrbeitrag
für 3 Tage
4,99 € inkl. MwSt.

webop-Account Single
Freischaltung aller Lehrbeiträge
Preis pro Monat
für das Modul: Allgemein- und Viszeralchirurgie