Duodenohemipankreatektomie mit Blumgart-Anastomose und bilio-pankreatischer Separation (Merheim-Methode) - Allgemein- und Viszeralchirurgie
Sie haben keine Lizenz erworben - paywall ist aktiv: zur Produktauswahl
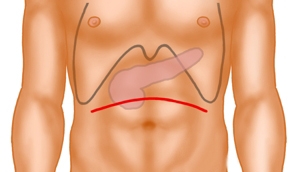
Laparotomie
Der Zugang erfolgt als bogenförmige, kranial konvexe, quere Oberbauchlaparotomie. Anschließend erfolgt die Explorationsphase mit Inspektion und Palpation des gesamten Abdomens zum Ausschluss von Fernmetastasen und Zeichen der lokalen Irresektabilität.
Nach Einbringen einer Folie als Bauchdeckenschutz wird ein Seilzughakensystem eingesetzt.
Bemerkung:
Alternativ kann bei sehr spitzem Rippenbogenwinkel eine mediane Laparotomie durchgeführt werden.
Eröffnung der Bursa omentalis
Eingehen in die Bursa omentalis, indem das Omentum von der rechten Kolonflexur bis zum linken Drittel des Colon transversum abgelöst wird. Nun kann das Pankreas auch nach linksseitig gut exploriert und entschieden werden, ob eine Infiltration des Magens bzw. postpylorischen Duodenums vorliegt. Verklebungen zwischen Pankreas und Magenhinterwand werden gelöst.
Bemerkung:
Das Duodenum sollte über eine Strecke von 2 bis 3 cm erhalten werden. Ist das nicht möglich, muss der Magen partiell reseziert werden.
Kocher-Manöver
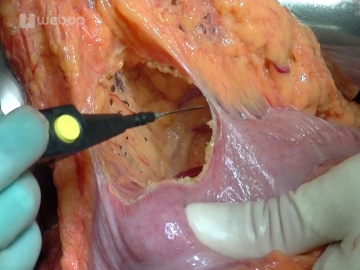
Zunächst Ablösen der rechten Kolonflexur von der Vorderfläche des Duodenums und des Pankreaskopfes. Dann erfolgt die Mobilisation des Duodenums nach Kocher. Der mobilisierte Kolonabschnitt wird zur linken Seite verlagert und das Duodenum nach Inzision entlang seiner Außenkante zusammen mit dem Pankreaskopf aus seinen retroperitonealen Verbindungen gelöst. Die Mobilisation des Pankreaskopfes wird über die Aortenebene hinweg bis zum Treitzschen Band fortgeführt bis der Pankreaskopf von dorsal komplett umfasst werden kann.
Es erfolgt die Palpation des mobilisierten Pankreaskopfes zum Ausschluss einer retroperitonealen Infiltration sowie die Palpation der Lymphabflußwege und der großen Gefäße.
Cholezystektomie
Die Resektionsphase beginnt mit der Cholecystektomie: Fassen der Gallenblase und antegrade subseröse Präparation aus dem Leberbett mittels bipolarer Schere, Darstellung von Ductus cysticus und Arteria cystica, welche zunächst am späteren Präparat belassen werden.
Bemerkung:
Zur Vermeidung einer aszendierenden Cholangitis nach biliodigestiver Anastomose ist die Cholezystektomie aus funktionellen Gründen im Rahmen der Pankreaskopfresektion obligat.
Präparation des Ligamentum hepatoduodenale mit Absetzen der Arteria gastrica dextra
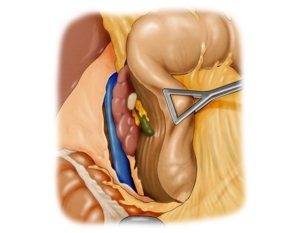
Die Präparation im Ligamentum hepatoduodenale umfasst die Darstellung der Arteria hepatica communis, der Arteria hepatica propria und der Arteria gastrodudenalis, der Vena portae und des Ductus hepatocholedochus (DHC).
In diesem Fall zeigt sich eine anatomische Variante der Gefäßversorgung der Leber. Eine atypische Arteria hepatica dextra aus der Arteria mesenterica superior kreuzt den DHC dorsal.
Die Lymphadenektomie wird in diesem Fall entlang der A. hepatica sinistra nach zentral Richtung Truncus coeliacus durchgeführt. Dabei kommt die Abzweigung der A. gastroduodenalis zur Darstellung.
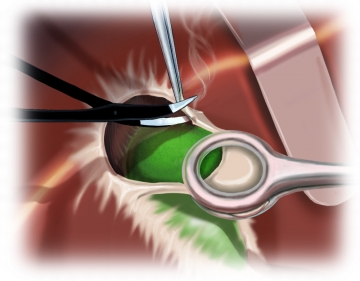
Die Durchtrennung der A. gastrica dextra unter Ligaturen ist der Beginn der Mobilisation des Pylorus.
Zuvor wird die Präparation des Ligaments mit der Darstellung der suprapankreatischen V. portae bis hinter das Pankreas abgeschlossen.
Durchtrennung des postpylorischen Duodenums und der Arteria gastroduodenalis
Absetzen und Skelettierung der 1. Jejunumschlinge
Durchzug des Jejunumstumpfes/ Präparation der Vena mesenterica superior
Durchtrennung Pankreas und DHC
Ablösen des Pankreaskopfes
Versiegelung der retroperitonealen Absetzungsfläche
Übernähung und retrokolischer Hochzug des Jejunalstumpfes
Pankreatiko-Jejunostomie nach Blumgart I (Hinterwand)
Pankreatiko-Jejunostomie nach Blumgart II (Vorderwand)
Bilden der Roux-Y Schlinge
Biliodigestive Anastomose
Wiederanschluss des Magens
Terminolaterale Jejunojejunostomie („Roux-Y-Rekonstruktion“)
Bauchdeckenverschluss
Einzelfreischaltung
Freischaltung auf diesen Lehrbeitrag
für 3 Tage
4,99 € inkl. MwSt.

webop-Account Single
Freischaltung aller Lehrbeiträge
Preis pro Monat
für das Modul: Allgemein- und Viszeralchirurgie