Eso-SPONGE® – Endoluminale Vakuumtherapie zur Behandlung von Anastomoseninsuffizienzen und Perforationen im oberen GI-Trakt - Allgemein- und Viszeralchirurgie
Sie haben keine Lizenz erworben - paywall ist aktiv: zur Produktauswahl
OP Durchführung
Bei einem 55 Jahre alten, männlichen Patienten mit einem Plattenepithelkarzinom des distalen Ösophagusdrittels war nach neoadjuvanter Radiochemotherapie eine abdomino-thorakale Ösophagusresektion mit Magenschlauchrekonstruktion und End-zu-End-Ösophago-Gastrostomie (Handnaht) durchgeführt worden. Am 5. postoperativen Tag kam es zu einem Anstieg der Infektparamater. Eine endoskopische Kontrolluntersuchung wies eine Anastomoseninsuffizienz nach, die ca. ¼ der Anastomosenzirkumferenz betraf in der Tiefe von 25cm ab Zahnreihe. Die dahinter liegende Insuffizienzhöhle konnte ca. 8 cm tief eingespiegelt werden. Im selben Untersuchungsgang erfolgte die erste Anlage eines Eso-Sponge in die Insuffizienzhöhle. Die folgenden Filmaufnahmen zeigen den 2. Eso-SPONGE®-Wechsel.
Vorbereitung
Das Eso-SPONGE®-Behandlungsset besteht aus einem offenporigen Polyurethanschwamm, der über einen Overtube und Pusher eingeführt, transnasal umgeleitet und im Anschluss an eine regelbare, medizinische Pumpe angeschlossen wird. Zur Vorbereitung der Therapie die Setbestandteile auspacken, ggf. kann der Drain des Schwammes schon durch den Pusher gefädelt werden. Steriles Hydrogel, NaCl oder Ringerlösung, eine Magensonde Ch. 16 sowie diverse Klemmen bereit legen.
Einspiegeln und Platzierung des Overtubes in der Insuffizienzhöhle
Vor der Anwendung von Eso-Sponge flexibel-endoskopische Untersuchung mit Ausmessen der Wundhöhle. Stülpen des Overtubes über das Endoskop (mit Gleitgel oder Silikonspray benetzen) und Einführen unter Sicht bis ans Ende der Insuffizienzhöhle – das Endoskop dient hierbei als Führungsschiene. Overtube auf Position halten und das Endoskop vorsichtig zurückziehen.
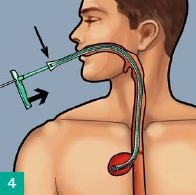
Einführen des Schwammes
Den ggf. auf die Größe der Wundhöhle zugeschnittenen Schwamm mit einem sterilen Hydrogel (Askina® Gel) benetzen und in den Overtube einführen. Eso-SPONGE® mittels Pusher bis zur Markierung vorschieben – der Schwamm befindet sich nun am Ende des Overtubes. Den Pusher auf Position halten und den Overtube bis zum Handgriff des Pushers zurückziehen, dadurch wird der Schwamm in der Insuffizienzhöhle freigesetzt. Overtube und Pusher können nun gemeinsam entfernt werden. Endoskopische Lagekontrolle des Schwammes und ggf. Korrektur mittels endoskopischer Fasszange.
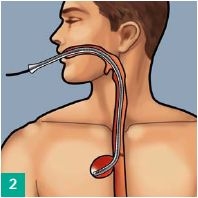
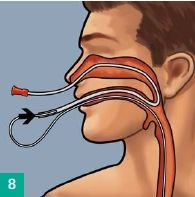
Transnasale Ausleitung
Eine Magensonde oder ein Absaugkatheter CH 16 (nicht im Set enthalten) durch die Nase einführen und durch den Mund herausleiten, ggf. Abschneiden der atraumatischen Spitze. Konnektierung des Eso-SPONGE®-Drains mit der Magensonde vor dem Mund. Zurückziehen der Magensonde zusammen mit dem Drain durch die Nase. Der Drain ist nun transnasal ausgeleitet.
Konnektierung des Drains an das Y-Stück
Anschluss an eine regelbare, medizinische Pumpe
Schwammwechsel
Abschlussendoskopie
Einzelfreischaltung
Freischaltung auf diesen Lehrbeitrag
für 3 Tage
4,99 € inkl. MwSt.

webop-Account Single
Freischaltung aller Lehrbeiträge
Preis pro Monat
für das Modul: Allgemein- und Viszeralchirurgie