Fundoplicatio, laparoskopisch nach Toupet - Allgemein- und Viszeralchirurgie
Sie haben keine Lizenz erworben - paywall ist aktiv: zur Produktauswahl
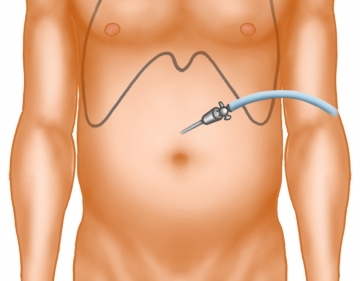
Hautinzision
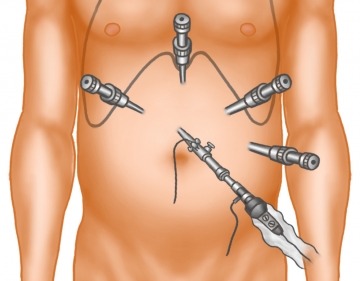
Trokarpositionierung
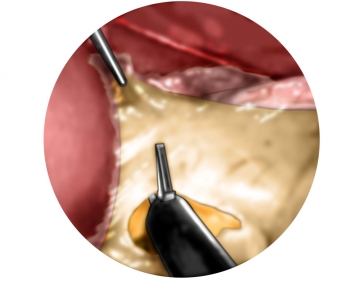
Anspannen des Magen und Netzinzision
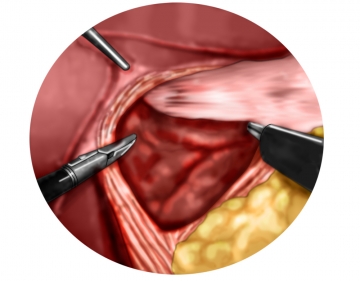
Präparation der Zwerchfellschenkel mit Eingang ins Mediastinum
Mobilisation des Magenfundus
Präparation des unteren Ösophagus
Hintere Hiatoplastik
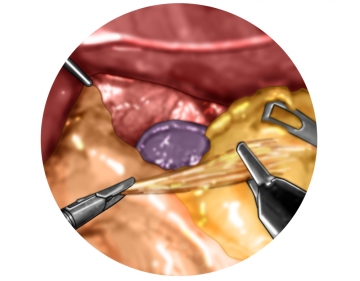
Shoeshinetest
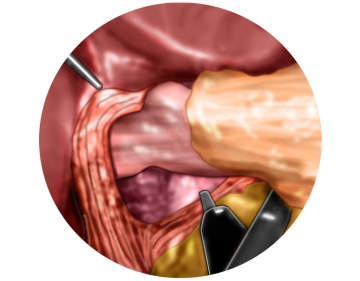
Fixation der Fundusmanschette I
Fixation der Fundusmanschette II
Fixation linker Fundus
Naht und Verband
Aktualisierung vom: 20.08.2023
Publikation vom: 25.04.2009
Einzelfreischaltung
Freischaltung auf diesen Lehrbeitrag
für 3 Tage
4,99 € inkl. MwSt.

webop-Account Single
Freischaltung aller Lehrbeiträge
Preis pro Monat
für das Modul: Allgemein- und Viszeralchirurgie