Hemikolektomie rechts - Allgemein- und Viszeralchirurgie
Sie haben keine Lizenz erworben - paywall ist aktiv: zur Produktauswahl
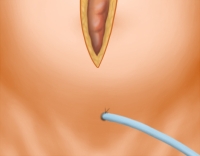
Laparotomie
Exploration
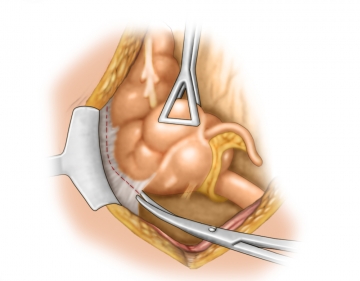
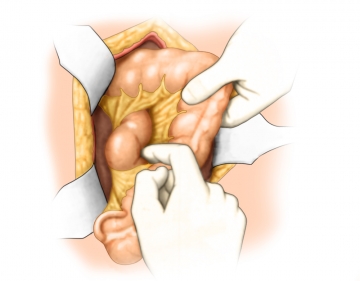
Mobilisierung Colon ascendens
Die Präparation des rechten Hemikolons erfolgt von lateral nach medial und beginnt mit der Inzision des Peritoneums lateral des Dickdarms. Damit gelangt man unmittelbar in den spaltförmigen Raum zwischen der die retroperitonealen Organe bedeckenden parietalen Faszie und der kontinuierlich über alle intraperitonealen Organe hinweg ziehenden mesenterialen/viszeralen Faszie.
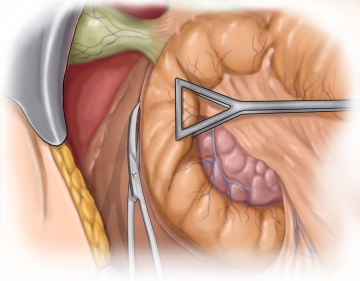
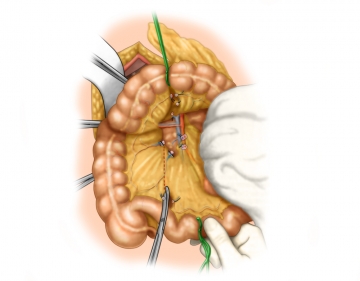
Präparation der Mesenterialwurzel
Von dorsal her wird nun das Mesokolon mit der gesamten Mesenterialwurzel nach ventral mobilisiert.
Durch Präparation entlang des dorsalen Blatts der mesokolischen Faszie und strikter Vermeidung einer Verletzung des Mesokolon ascendens erreicht man unter kompletter Mobilisierung des Colon ascendens die Mesenterialwurzel. Somit wird ein kontrollierter Zugang zur Vena mesenterica superior mit den dort einmündenden Venen und dem Ursprung der Kolonarterien ermöglicht.
Kocher-Manöver
Die Mobilisierungsebene reicht entlang des dorsalen Blattes des Mesokolons bis unter das Duodenum mit Pankreaskopf, so dass ein Kocher-Manöver resultiert. Duodenum und Pankreaskopf werden ebenfalls von der viszeralen Faszie, dem Mesoduodenum bzw. Mesopankreas bedeckt. Dieses Mesoduodenum wird von der parietalen Faszienschicht, die Vena cava und Aorta bedeckt, separiert.
Bemerkung: Am Ende des Videos demonstriert der Operateur die Ablösung des mesenterialen Blattes hier des Mesoduodenums und Mesopankreas vom parietalen Blatt, das Vena cava und Aorta bedeckt.
Abpräparation des Duodenums von der Mesenterialwurzel
Eröffnen der Bursa omentalis
Lymphknotendissektion im Bereich des Pankreaskopfes
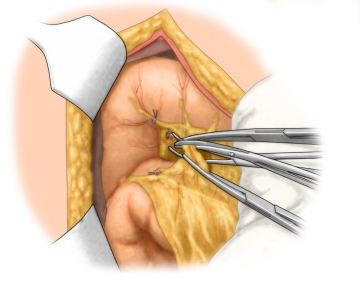
Durchtrennung der A. und V. ileocolica
Durchtrennung der A. colica dextra
Durchtrennung des Ileums
Durchtrennung des Colons; Abgabe des Präparates
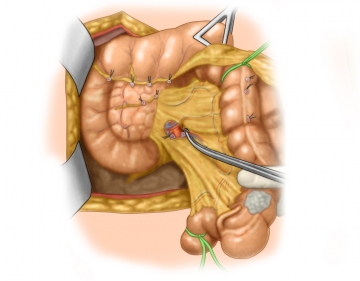
Ileotransversostomie
Mesenterialnaht
Robinson-Drainage; Bauchdeckenverschluss
Einzelfreischaltung
Freischaltung auf diesen Lehrbeitrag
für 3 Tage
4,99 € inkl. MwSt.

webop-Account Single
Freischaltung aller Lehrbeiträge
Preis pro Monat
für das Modul: Allgemein- und Viszeralchirurgie