Leistenhernienreparation in TEP-Technik - Allgemein- und Viszeralchirurgie
Sie haben keine Lizenz erworben - paywall ist aktiv: zur Produktauswahl
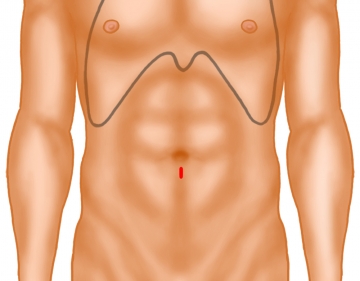
Zugang zum Präperitonealraum
1 cm langer Hautschnitt unterhalb des Nabels. Auseinanderdrängen des Fettgewebes mit Langenbeckhaken und Darstellen der Faszie bzw. vorderen Rektusscheide. Diese wird mit dem Stichskalpell auf der zu versorgenden Seite paramedian auf einer Länge von ca. 1 cm inzidiert. Der mediale Faszienrand wird mit einer scharfen Klemme gefasst und nach ventral gezogen. Mit dem Langenbeckhaken geht man dann unter den M. rectus und hebt diesen nach ventral an.
Tipp: Bei genau medianer Inzision der Faszie gelangt man direkt in das Abdomen und nicht in die Rektusscheide. Die Faszie muss dann wieder verschlossen und weiter lateral inzidiert werden!
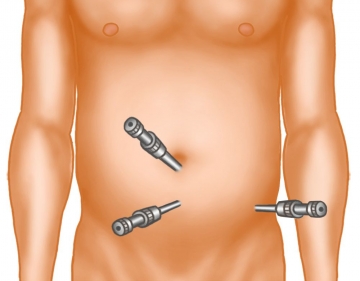
Einbringen der Trokare
Mit einem langen Präparationstupfer wird auf dem hinteren Blatt der Rektusscheide der präperitoneale Raum bis retrosymphysär stumpf disseziert. Danach stumpfes Einbringen des 10er-Trokars und Gasinsufflation mit Drücken zwischen 10 – 15 mm Hg. Einführen der Kameraoptik. Unter Sicht wird jetzt ein 5er-Trokar in der Medianebene genau mittig zwischen Bauchnabel und Symphyse eingebracht.
Tipp: Vor Einbringen des 5er-Trokars auf die epigastrischen Gefäße achten, die regelhaft sichtbar sind. Verwendung von Trokaren mit Feststellmechanismus, da diese sonst rutschen und die Präparation massiv erschweren!
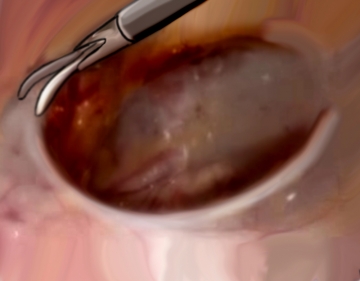
Präparation des Präperitonealraumes
Über den 5er-Trokar wird jetzt mit der Schere hauptsächlich stumpf der präperitoneale Raum disseziert. Dazu beginnt man retrosymphysär und schiebt in einer Bewegung von ventral nach dorsal das Gewebe von der Schambeinrückseite zur Blase hin ab. Kleine, kreuzende Gefäße können koaguliert werden.
Anschließend wird in gleicher Weise nach lateral stumpf disseziert, bis die laterale Begrenzung der Rektusscheide erscheint. Diese wird jetzt in winzigen Schritten mit der Schere durchtrennt, bis die Ebene der Spina iliaca anterior superior erreicht ist. Ca. 2 cm medial der Spina wird der zweite 5er-Trokar unter Sicht eingebracht.Tipp: Der laterale Rand der Rektusscheide muss möglichst weit ventral scharf durchtrennt werden, da man sonst direkt in das Abdomen gelangt!
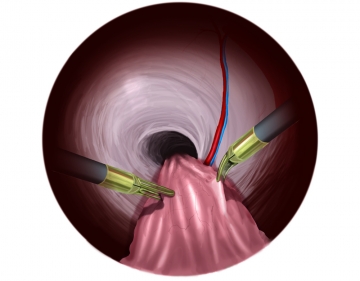
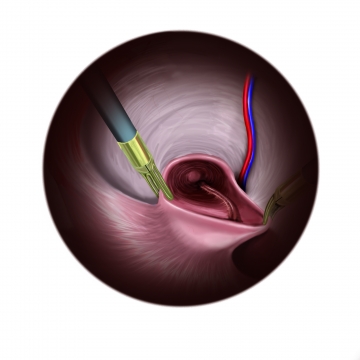
Präparation des direkten Bruchsacks
Ab jetzt benutzt man Dissektor und feine Fasszange über beide 5er-Trokare. Durch Zug und Gegenzug erreicht man eine gründliche, stumpfe Dissektion des präperitonealen Raumes.
Exemplarisch wird nun auf der rechten Seite eine direkte Hernie präpariert. Bruchsack und Bruchinhalt werden stumpf mit beiden Instrumenten aus der Bruchpforte gezogen.Tipp: Da die Präparation extrem nahe an den Femoralgefäßen erfolgt, muss auf venöse Seitenäste geachtet werden, die bei Verletzung heftig bluten und viel Geduld und Erfahrung bei der Blutstillung erfordern!
Präparation des indirekten Bruchsacks
Platzieren des Netzes
Verschluss der Inzisionen
Einzelfreischaltung
Freischaltung auf diesen Lehrbeitrag
für 3 Tage
4,99 € inkl. MwSt.

webop-Account Single
Freischaltung aller Lehrbeiträge
Preis pro Monat
für das Modul: Allgemein- und Viszeralchirurgie