Leistenhernienreparation in TEP-Technik mit DynaMesh ENDOLAP 3D - Allgemein- und Viszeralchirurgie
Sie haben keine Lizenz erworben - paywall ist aktiv: zur Produktauswahl
Zugang zum Extraperitonealraum
Nach subumbilikaler querer Hautinzision wird das vordere Rektusscheidenblatt mit zwei Langenbeckhaken dargestellt und quer mit dem Skalpell inzidiert. Der mediale Rand des Rektusmuskels wird auf den Haken geladen und ein Dissektionsballon eingebracht. Dieser gleitet auf dem hinteren Blatt der Rektusscheide bis zum Os pubis. Unter Sichtkontrolle mit der 0°-Optik werden durch die Aufdehnung des extraperitonealen Raums die Leitstrukturen Os pubis, Rektusmuskel und epigastrische Gefäße stumpf disseziert und eindeutig identifiziert. Der Ballon wird entfernt und die inzidierte vordere Rektusscheide mit geflochtenen, resorbierbaren Fäden der Stärke 0 armiert.
Einbringen des Optik- und ersten Arbeitstrokars
Nun wird ein stumpfer gasdichter 10er Trokar mit Fixiervorrichtung eingebracht und mit den vorgelegten Fäden fixiert. Meistens reicht ein Arbeitsdruck von 7 mmHg, um den Extraperitonealraum ausreichend zu entfalten. Mindestens 5 cm oberhalb des Schambeins wird in der Mittellinie ein 5er Trokar eingesetzt.
Tipp:
Empfohlen wird ein nicht leitender, kurzer 5er Trokar mit Gewinde.Präparation des Extraperitonealraums mit Einbringen des dritten Trokars
Mit Overholt und Optik wird zunächst der mediale Präperitonealraum erweitert, dabei wird die Mittellinie überschritten. Die Dissektion geht von hieraus nach lateral, wobei eine große mediale Hernie gut zu erkennen ist. Die seitliche Präparation entlang dem Musculus transversus abdominis wird bis in Höhe des Nabels fortgesetzt. Auf dieser Ebene in der vorderen Axillarlinie wird nun der dritte Trokar, wahlweise als 5er oder wie im Beispiel als 10er Trokar eingebracht.
Bemerkungen:
- Durch diese Position des zweiten Arbeitstrokars kann eine gute Triangulation erreicht werden.
- Bei der lateralen Präparation ist insbesondere bei Verwendung der Elektrokoagulation der Verlauf des Nervus cutaneus femoris lateralis zu beachten.
Ablösen des Bruchsacks von den Samenstranggebilden
Nachdem alle Trokare eingebracht sind, wechselt der Kameramann seine Position und steht nun hinter dem Operateur. Der Tisch wird zur Seite des Teams geneigt, eine Kopftieflage von 10° ist meist hilfreich.
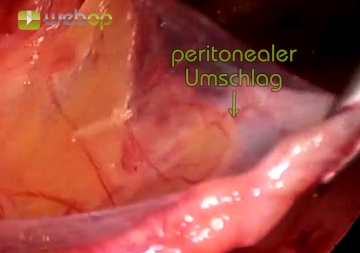
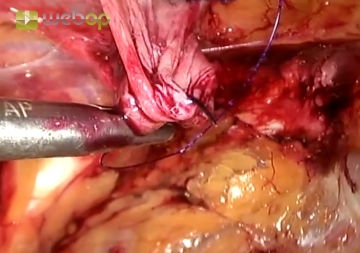
Ein großer direkter Bruchsack wird nun unter Identifizierung des Ductus deferens und der Gefäße vom Samenstrang abgelöst und ausreichend weit nach kranial präpariert, um später eine optimale Netzplatzierung zur ermöglichen.Abpräparation des Peritoneums (Parietalisierung)
Reicht die Linea arcuata weit herunter, wie im Beispiel, sollte sie lateral inzidiert werden. Der letzte Akt der Dissektion ist dann die Abpräparation des Peritoneums von den Samenstranggebilden bzw. der Fascia spermatica bis über die Mitte des Psoas bauchwärts. Sämtliche auch kleinste faserartige Verbindungen zwischen Peritoneum und Retroperitoneum sind dabei zu durchtrennen. Hier kommen jetzt die Leistennerven zur Darstellung, lateral vom Musculus psoas der Nervus cutaneus femoris lateralis, medial der Nervus genitofemoralis.
Raffung der Fascia transversalis
Prinzipien und Landmarken der Endolap 3D- Positionierung
Einbringen des Netzes
Positionieren des Netzes
Kontrolliertes Ablassen des CO2; Wundverschluss
Einzelfreischaltung
Freischaltung auf diesen Lehrbeitrag
für 3 Tage
4,99 € inkl. MwSt.

webop-Account Single
Freischaltung aller Lehrbeiträge
Preis pro Monat
für das Modul: Allgemein- und Viszeralchirurgie