Narbenhernienreparation mit offener, retromuskulärer Netzaugmentation - Allgemein- und Viszeralchirurgie
Sie haben keine Lizenz erworben - paywall ist aktiv: zur Produktauswahl
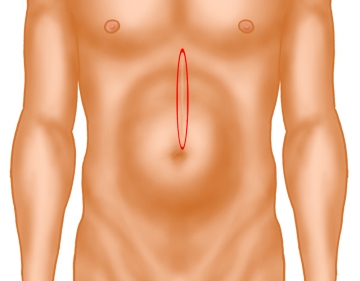
Exzision der Hautnarbe
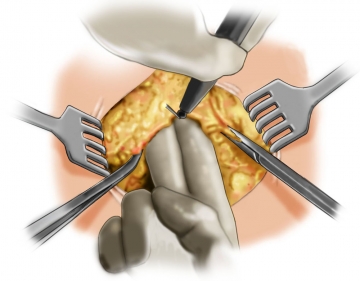
Freilegung des Fasziendefektes
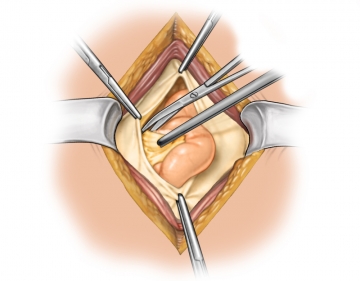
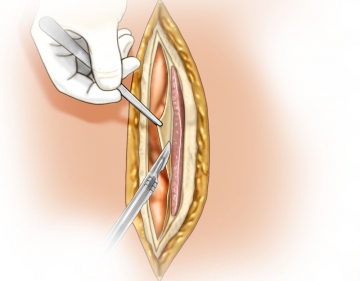
Eröffnung der Leibeshöhle
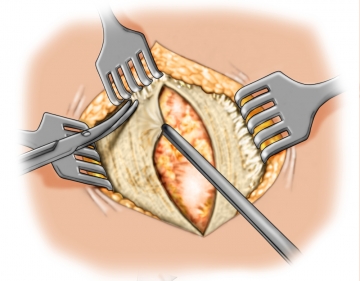
Lokale Adhäsiolyse
Die lokale Adhäsiolyse von viszeralen Organen aus dem Bruchsack und der angrenzenden Bauchdecke ermöglicht eine bessere Übersicht, verhindert iatrogene Darmläsionen bei der weiteren Präparation des Netzlagers.
Anschließend erfolgt die protektive Abdeckung des Bauchraums mit einem warmen, feuchten Tuch.Bemerkung: Eine inter-enterische Adhäsiolyse sollte nur bei entsprechender Beschwerdesymptomatik erfolgen.
Präparation der vorderen Faszie
Inzision der Rektusscheide
Präparation des Netzlagers
Verschluss der Bauchhöhle
Ausmessen des Netzlagers
Netzplatzierung und Fixation
Faszienverschluss der vorderen Rektusscheide
Refixation des Bauchnabels und schichtweiser Wundverschluss
Aktualisierung vom: 10.04.2024
Publikation vom: 25.04.2009
Einzelfreischaltung
Freischaltung auf diesen Lehrbeitrag
für 3 Tage
4,99 € inkl. MwSt.

webop-Account Single
Freischaltung aller Lehrbeiträge
Preis pro Monat
für das Modul: Allgemein- und Viszeralchirurgie