Ösophagusresektion - Allgemein- und Viszeralchirurgie
Sie haben keine Lizenz erworben - paywall ist aktiv: zur Produktauswahl
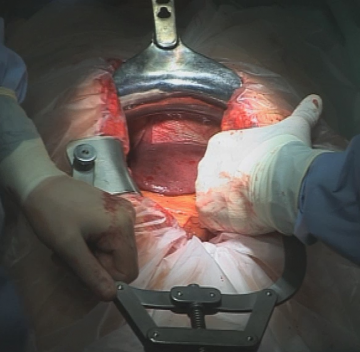
Laparatomie und Exploration
Nach sterilem Abwaschen und Abdecken sowie Überprüfung der Lagerung erfolgt ein Hautschnitt entlang der Mittellinie vom Xiphoid bis zum Nabel mit Linksumschneidung des Nabels. Eröffnung der Bauchhöhle in der Linea alba nach Durchtrennen des Subkutangewebes mit dem Elektrokauter.
Einbringen einer Innenabdeckfolie und eines Mercedes-Sperrers sowie eines Ulmer Retraktors.
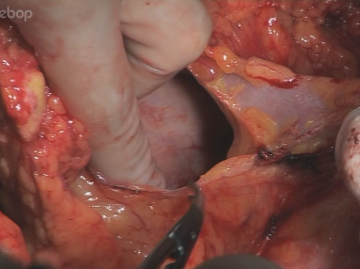
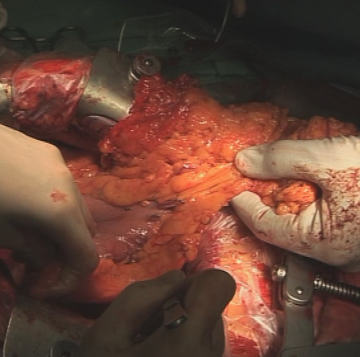
Exploration der gesamten Bauchhöhle zum Ausschluss einer Peritonealcarcinose und Lebermetastasierung ggf. durch Sonographie.Mobilisation des intraabdominellen Ösophagus
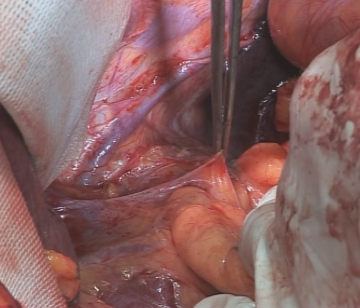
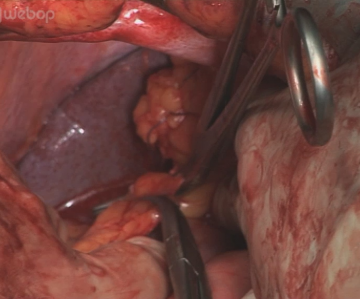
Lebernahe Inzision des kleinen Netzes. Eine atypisch aus der A. gastrica sinistra abgehende linksseitige Leberarterie, wie hier vorliegend, muss erhalten bleiben. Die Inzision wird auf das präösophageale Peritoneum erweitert, der Hiatus oesophageus in der Trennschicht zwischen re Zwerchfellschenkel und Ösophagus stumpf eröffnet. Stumpfe Präparation des Ösophagus kranial und zum li Zwerchfellschenkel. Anschlingen des Ösophagus mit einem Gummizügel.
Eröffnung des Hiatus oesophageus mit Präparation des distalen Ösophagus
Duodenalmobilisation
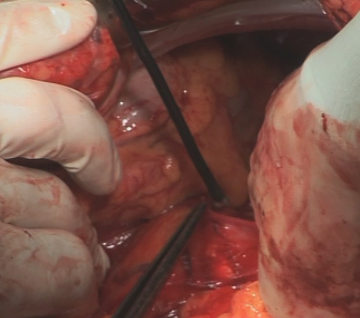
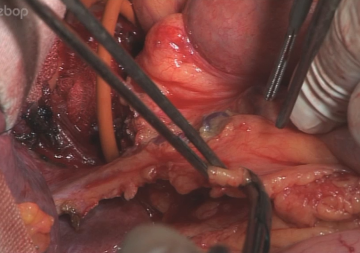
Um eine spannungslose Mageninterposition zu erreichen, erfolgt eine ausgiebige Duodenalmobilisation nach Kocher. Diese erfolgt von lateral her so weit , dass V.cava und medialer Rand der Aorta freigelegt sind. Anschließend sind Dodenum und Pankreaskopf so beweglich, dass der Pylorus ohne Schwierigkeiten bis in den Hiatus oesophagus nach oben geführt werden kann.
Eröffnung der Bursa omentalis
Abpräparation des Omentum majus vom Colon transversum und Eröffnung der Bursa omentalis. Dabei wird das große Netz zunächst an der großen Kurvatur belassen. Das große Netz wird im Bereich des Lig. gastrolienale milznah mit Overholt-Klemmen abgesetzt.
Tipp: Die Milz sollte bei der cranialen Präparation mit einem Bauchtuch hinterlegt werden um Zug zu verhindern, der zum Einreißen der Milz führen kann, ggf. muss großzügig splenektomiert werden.
Mobilisierung des Magens
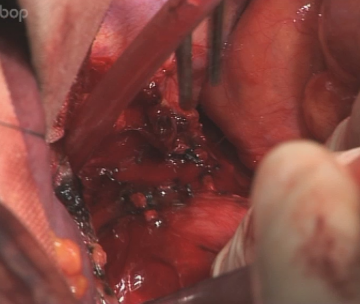
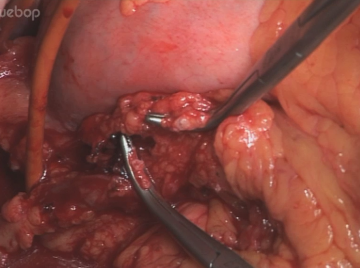
Abdominelle Lymphadenektomie
Durchtrennung der V. coronaria ventriculi und A. gastrica sinistra
Entfernung des großen Netzes
Magenschlauchbildung
Übernähung und Transposition des Magenschlauches
Thorakotomie
En-bloc-Ösophagektomie
Magenhochzug und intrathorakale Anastomose
Deckung der Anastomose und Kürzen des Magenschlauches
Verschluss der Thorakotomie
Anlegen einer Ernährungssonde
Verschluss der Bauchdecke
Einzelfreischaltung
Freischaltung auf diesen Lehrbeitrag
für 3 Tage
4,99 € inkl. MwSt.

webop-Account Single
Freischaltung aller Lehrbeiträge
Preis pro Monat
für das Modul: Allgemein- und Viszeralchirurgie