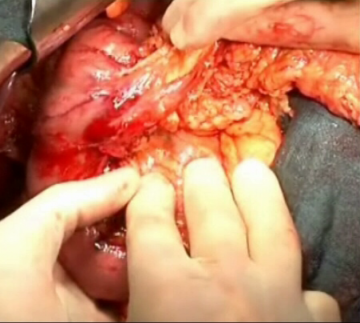
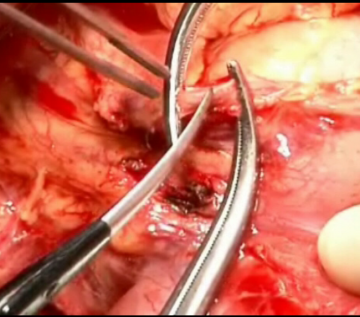
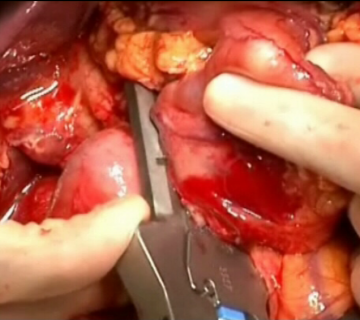
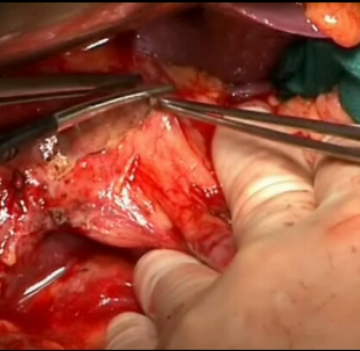
Pankreatikoduodenektomie, pyloruserhaltend, partiell (OP nach Traverso) - Allgemein- und Viszeralchirurgie
Sie haben keine Lizenz erworben - paywall ist aktiv: zur Produktauswahl
Laparotomie
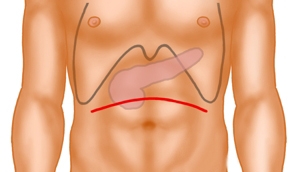
Der Zugang erfolgt als bogenförmige kranial konvexe quere Oberbauchlaparotomie. Anschließend erfolgt die Explorationsphase mit Inspektion und Palpation des gesamten Abdomens zum Ausschluss von Fernmetastasen und Zeichen der lokalen Irresektabilität.
Alternativ kann bei sehr spitzem Rippenbogenwinkel eine mediane Laparotomie durchgeführt werden.
Cholezystektomie
Nach Anklemmen der Gallenblase erfolgt die subseröse Präparation der Gallenblase aus dem Leberbett Durchtrennen von Ductus cyscticus und A. cystica unter entsprechenden Ligaturen und Abgabe des Präparats zur Histologie.
Tipp: Zur Vermeidung einer aszendierende Cholangitis nach biliodigestiver Anastomose ist die Cholezystektomie aus funktionellen Gründen im Rahmen der Pankreaskopfresektion obligat.
Eröffnung der Bursa omentalis
Kocher’sche Mobilisation
Nach Mobilisation der rechten Kolonflexur erfolgt die Kocher’sche Mobilisation des Duodenums.
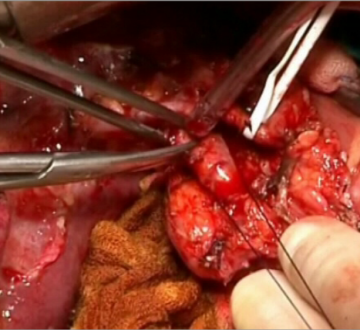
Palpation des Pankreaskopfes
Ligatur A. gastrica dextra
Durchtrennung des postpylorischen Duodenums
Lymphadenektomie I
Durchtrennung des Ductus choledochus
Durchtrennung A. gastroduodenalis
Lymphadenektomie II
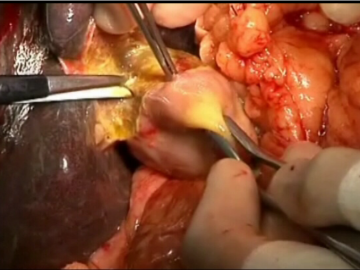
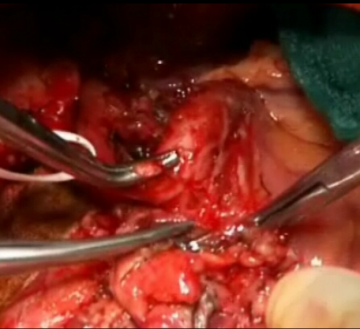
Durchtrennung Pankreas
Ablösen des Pankreaskopfes
Durchtrennung Jejunum
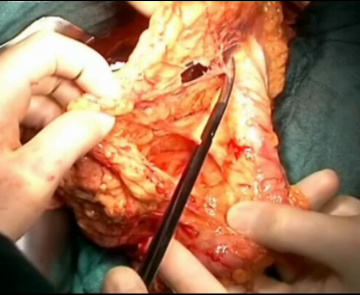
Durchtrennung der retropankreatische Platte und Resektion
Naht Mesoschlitz
Übernähung Jejunalstumpf
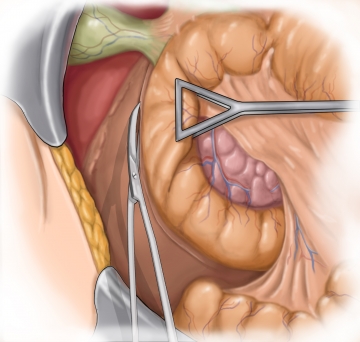
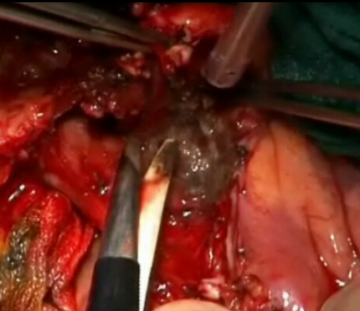
Anlage des Pankreatiko-Jejunostomie I
Anlage des Pankreatiko-Jejunostomie II – duct-to-mucosa
Biliodigestive Anastomose
Duodeno-Jejunostomie
Bauchdeckenverschluss
Einzelfreischaltung
Freischaltung auf diesen Lehrbeitrag
für 3 Tage
4,99 € inkl. MwSt.

webop-Account Single
Freischaltung aller Lehrbeiträge
Preis pro Monat
für das Modul: Allgemein- und Viszeralchirurgie