Peritonealdialyse: Offene Katheterimplantation für die CAPD - Allgemein- und Viszeralchirurgie
Sie haben keine Lizenz erworben - paywall ist aktiv: zur Produktauswahl
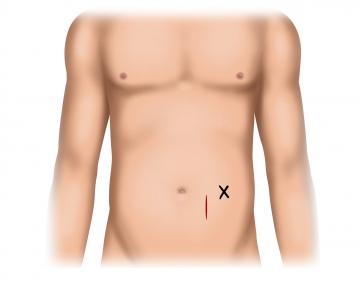
Pararektaler Hautschnitt und Darstellung des vorderen Rektusscheidenblatts
Darstellung des hinteren Rektusscheidenblatts und Eröffnung des Peritoneums
Längsverlaufende Inzision des vorderen Rektusscheidenblatts und stumpfes Spreizen der Rektusmuskulatur. Eröffnung des Peritoneums oberhalb der Linea arcuata und Vorlegen der Peritonealnaht am kaudalen Pol der Inzision (PDS 3-0).
Tipp:
- Aus Stabilitätsgründen empfiehlt sich, die Katheterimplantation oberhalb der Linea arcuata durchzuführen.
- Für die Peritonealnaht, die auch der Verankerung des Katheters dient, sollte ein monofiler Faden verwendet werden, um das Aufreißen der Stichkanäle zu verhindern.
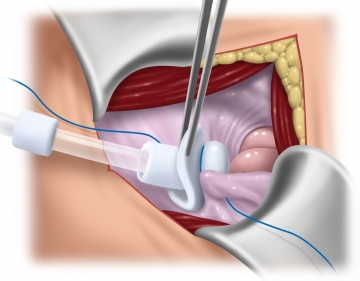
Platzieren des Dialysekatheters und Peritonealverschluss
Einbringen des CAPD-Katheters mittels einer Kornzange in den Douglasraum. Bei der anschließenden fortlaufenden Peritonealnaht (PDS 3-0) wird der Katheter so in die Naht integriert, dass die Silikonperle des Katheters intraabdominell dem Peritoneum anliegt und der Filzteller vor dem hinteren Rektusscheidenblatt extraperitoneal zu liegen kommt. Anschließend ist der Katheter fest verankert und die Peritonealnaht „wasserdicht“.
Ausleiten des Dialysekatheters
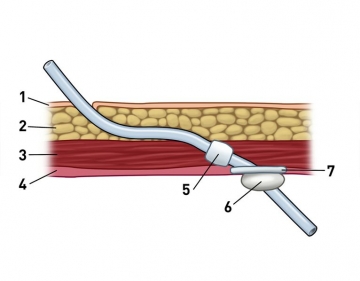
Abb. rechts: (1) Haut, (2) Subkutis, (3) Rektusmuskulatur, (4) Peritoneum/Faszie, (5) Filz-Cuff, (6) Silikonperle, (7) Filz-Teller
Aufsetzen des Tunnelierungstrokars auf das freie Katheterende und kulissenartiger Durchzug des Katheters durch die Rektusmuskulatur und transkutanes Ausleiten an der zuvor markierten Stelle. Bei diesem Manöver kommt der 2. Filz-Cuff innerhalb der Rektusmuskulatur zu liegen. Aufsetzen des Titanadapters.
Tipp:
- Bei der submuskulären Ausleitung des Katheters sollte dieser harmonisch verlaufen, Abknickungen sind zu vermeiden.
Überprüfung der korrekten Katheterplatzierung via Durchleuchtung
Funktionstest des Dialysekatheters
Wundverschluss; Verband
Einzelfreischaltung
Freischaltung auf diesen Lehrbeitrag
für 3 Tage
4,99 € inkl. MwSt.

webop-Account Single
Freischaltung aller Lehrbeiträge
Preis pro Monat
für das Modul: Allgemein- und Viszeralchirurgie