Rektovaginale Fistel: Anteriore Levatorplastik mit simultaner Sphinkterrekonstruktion - Allgemein- und Viszeralchirurgie
Sie haben keine Lizenz erworben - paywall ist aktiv: zur Produktauswahl
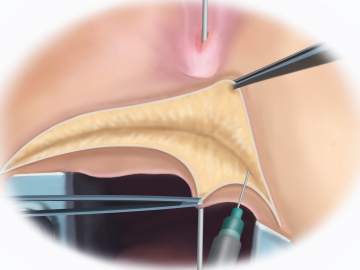
Fistelsondierung, NaCl-Injektion und quere Inzision am Damm
Der Eingriff beginnt mit dem Einsetzen des Analspreizers und der Sondierung der rektovaginalen Fistel, die sich im Filmbeispiel als eine Verbindung zwischen dem Rektum und dem unteren Drittel des Vaginalrohrs darstellt. Um die Präparation zu erleichtern wird zunächst in sog. Unterspritztechnik physiologische NaCl-Lösung perkutan injiziert. Sodann erfolgt der leicht bogenförmige Zugang über dem Perineum mittels Elektronadel. Nach Durchtrennung der Subkutis wird der Analretraktor eingesetzt.
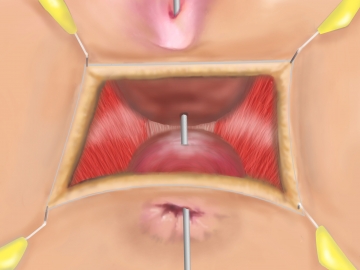
Präparation des Spatium rectovaginale; Darstellen des Sphinkter externus und M. puborektalis
Dissektion des Spatium rectovaginale mittels Elektronadel unter subtiler Blutstillung. Die Präparation muss bis jenseits des Fistelganges erfolgen und eine sichere Identifikation der Levatoren lateral der Vagina und des Anorektums ermöglichen. Ziel ist eine Approximation der Levatorenschenkel als Barriere zwischen vaginaler Hinterwand und Rektumvorderwand wie in den folgenden Schritten beschrieben.
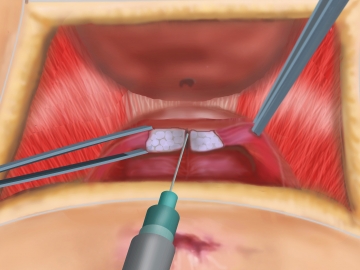
Präparation der Schließmuskelstümpfe
Zur Vorbereitung der Schließmuskelrekonstruktion werden die Muskelstümpfe aufgesucht. Die Präparation wird durch NaCl-Unterspritzung des Anoderms erleichtert. Nach Durchtrennung der Sphinkternarbe bei 12 Uhr in SSL (Steinschnittlage) werden die beiden Schließmuskelstümpfe im Bereich der vorderen Zirkumferenz frei präpariert.
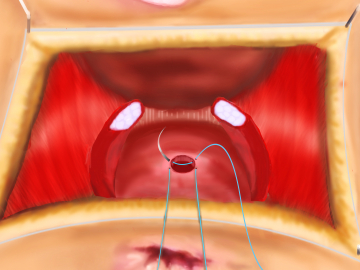
Exzision der Fistelöffnung im Rektum und Naht
Anteriore Levatorplastik
Sphinkterrekonstruktion
Dammaufbau, Wundverschluss
Einzelfreischaltung
Freischaltung auf diesen Lehrbeitrag
für 3 Tage
4,99 € inkl. MwSt.

webop-Account Single
Freischaltung aller Lehrbeiträge
Preis pro Monat
für das Modul: Allgemein- und Viszeralchirurgie