Totale Thyreoidektomie bei benigner Knotenstruma bds. - Allgemein- und Viszeralchirurgie
Sie haben keine Lizenz erworben - paywall ist aktiv: zur Produktauswahl
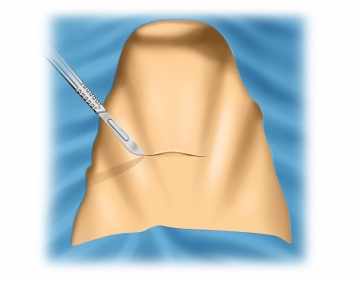
Hautschnitt
Die OP-Technik wird anhand einer Struma multinodosa II° demonstriert. Begonnen wird mit der rechten Seite.
Kocher´scher Kragenschnitt ca. 2 Querfinger oberhalb des Jugulums.
Tipp:
Ein zu tief liegender Hautschnitt kann zur Keloidbildung führen.
Bei großen Strumen sollte man den Schnitt höher anlegen, da er sich nach Entfernung der Struma senkt.Mobilisation der Wundränder
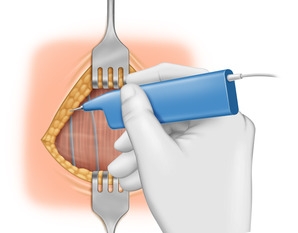
Mobilisation der geraden Halsmuskulatur
Eingehen in die Linea alba colli und beidseits Mobilisation der geraden Halsmuskulatur.
Tipp:
Um Blutungen aus den Venen zu vermeiden, ist es hier wichtig, den richtigen bindegewebigen Raum zwischen Schilddrüse und Muskulatur zu finden. Nach einer abgelaufenen Entzündung kann sich dieses Manöver schwierig gestalten.
Bei großen Strumen empfiehlt sich die quere Durchtrennung der infrahyoidalen Muskulatur.Darstellen und Neuromonitoring des N. vagus
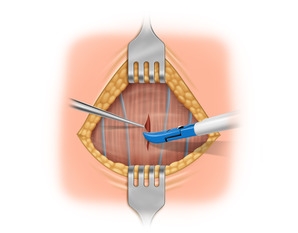
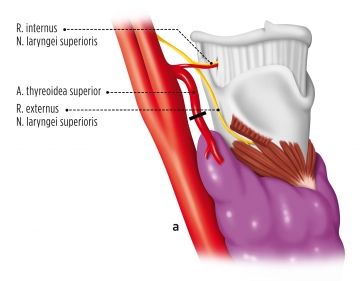
Darstellen und Absetzen der oberen Polgefäße
Mobilisation des oberen Schilddrüsenpols und drüsennahe Durchtrennung der oberen Polgefäße mittels LigaSure®.
Cave:
Bei zu starkem Zug an der Schilddrüse reißen die Venen an der nächsten Abzweigung, also kranial ab. Die Suche und Ligatur kann sich dann schwierig gestalten!
Bei hoch hinaufreichendem Pol besteht, wenn die Ligaturen nicht schilddrüsennahe erfolgen, die Gefahr einer Läsion des R. externus des N. laryngeus superior.
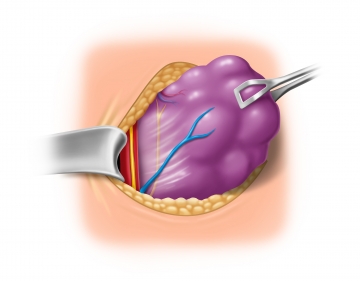
Tipps zur Vermeidung einer Nachblutung aus den Polgefäßen finden Sie hier: PolgefäßeAbpräparieren der unteren Nebenschilddrüse und Darstellen des N. laryngeus recurrens
Mobilisation des unteren Schilddrüsenpols
Darstellen der oberen Nebenschilddrüse und Verfolgen des N. laryngeus recurrens bis zum Kehlkopf
Mobilisation des Schilddrüsenlappens nach medial
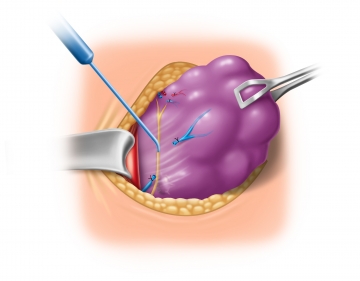
Exstirpation der Schilddrüse in toto
Wundverschluss
Einzelfreischaltung
Freischaltung auf diesen Lehrbeitrag
für 3 Tage
4,99 € inkl. MwSt.

webop-Account Single
Freischaltung aller Lehrbeiträge
Preis pro Monat
für das Modul: Allgemein- und Viszeralchirurgie