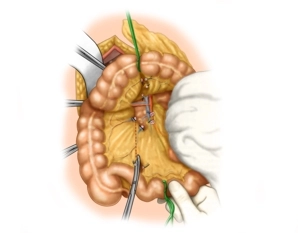
Die Naht wird hier exemplarisch an einer Hemikolektomie rechts gezeigt. Geplant ist eine Ileotransversostomie. Bedingt durch die langen Mesenterien liegen hier wendbare Verhältnisse vor, sodaß in Wendetechnik zunächst die Vorderwand, dann die Hinterwand gearbeitet wird.
-
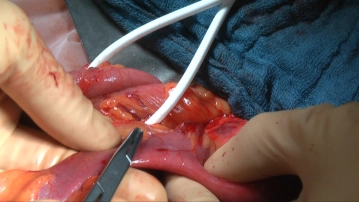
Auswahl der Darmschlinge
![Auswahl der Darmschlinge]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann. -
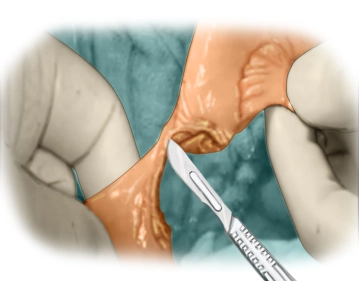
Präparation der Darmwand
![Präparation der Darmwand]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Zunächst werden beide Darmwände im Bereich der geplanten Anastomose freipräpariert. Dabei soll die Skelettierung der Darmwand am Dünndarm weniger als 1,5 cm und am Dickdarm höchstens 0,5-1 cm betragen. Stets ist auf eine gesunde grau-rötliche Gewebsfarbe des Darmes, blutende Wundränder und tast- oder sichtbare Pulse der im nähenden Darmabschnitt befindlichen Arterien zu achten.
-
Resektion des Darmabschnittes
![Resektion des Darmabschnittes]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Der Darm wird mit Darmklemmen verschlossen. Das Absetzen des Darmes erfolgt mit dem Skalpell, um die Durchblutung der Darmwand nicht zu gefährden.
Hinweis: Die Resektion des Ileum wird schräg ausgeführt, um die Lumendifferenz zum Colon transversum auszugleichen, ggf. wird das Ileum zusätzlich antimesenterial geschlitzt.
-
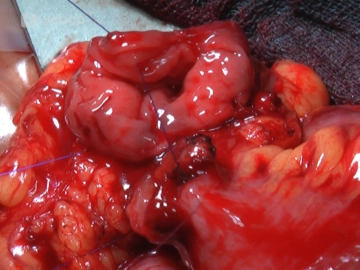
Darmnaht 1 (Legen der Haltefäden)
![Darmnaht 1 (Legen der Haltefäden)]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Prinzip:
Einreihige fortlaufende, extramuköse Allschichtnaht, mit zwei resorbierbaren Fäden
Material:
Synthetischer resorbierbarer Faden, monofil oder geflochten, Stärke 3–0 oder 4–0Zunächst wird jeweils eine Naht als Orientierungs- und Haltefaden mesenterial und antimesenterial angelegt. Damit wird das jeweilige Darmlumen halbiert und dem korrespondierenden Teil der Gegenseite zugeteilt. Die Enden des antimesenterialen Haltefaden werden miteinander verknüpft. Die eine Hälfte des Fadens dient wiederum als Haltefaden, mit der anderen Hälfte wird die Vorderwand der Anastomose genäht.
Beim Stechen der Naht wird darauf geachtet, die Mukosa nicht mitzufassen (extramuköse Naht), diese
Jetzt freischalten und direkt weiter lernen.
Einzelfreischaltung
Freischaltung dieses Lehrbeitrags für 3 Tage.
Beliebtestes Angebot
webop - Sparflex
Kombiniere flexibel unsere Lernmodule und spare bis zu 50%.
87,34 $/ jährliche Abrechnung
Allgemein- und Viszeralchirurgie
Alle Lehrbeiträge in diesem Modul freischalten.
174,70 $ / jährliche Abrechnung