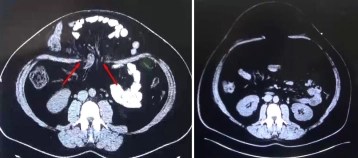
Bei der jungen Patientin hatte sich postpartal – ohne vorangegangenen abdominellen Eingriff – eine monströse Bauchdeckenhernie entwickelt, die zu einer Verlagerung großer Dünndarmanteile in den Bruchsack führte (linkes CT-Bild mit der markierten Bruchpforte).
Mit zunehmender Größe von Bauchdeckenhernien kommt es zur Retraktion der Bauchdeckenmuskulatur sowie einer Abflachung des Zwerchfells, wobei der erniedrigte Zwerchfelltonus zu einer respiratorischen Insuffizienz führen kann. Bei fortgeschrittener Eventration und ggf. Komplettverlust der Reponibilität des Bruchsacks bzw. seines Inhalts würde die gewaltsame Reposition im Rahmen der Hernienversorgung nicht nur zu einer Lungenkompression führen, sondern auch das Ergebnis der Hernienreparation gefährden, sodass in diesen Fällen eine Konditionierung der Bauchdecken durch ein präoperatives progressives Pneumoperitoneum ratsam ist. Durch die sukzessive Luftinsufflation kommt es zu einer Dehnung der Bauchdecke und einer schrittweisen Tonisierung des Zwerchfells, sodass die Reposition des Bruchinhalts und eine spannungsfreie Reparation der Faszenlücke möglich werden. Das eindrucksvolle Ergebnis des präoperativen Pneumoperitoneums – Spontanreposition des Bruchsackinhalts – zeigen ebenfalls die CT-Bilder (rechtes CT-Bild).
An die geplante Versorgung der Bauchdeckenhernie durch eine Netzaugmentation in Sublay-Technik werden besondere Ansprüche gestellt, da die junge Patientin ihre Familienplanung noch nicht abgeschlossen hat:
1. Verwendung eines resorbierbaren Biomeshs,
2. Adhäsionsprophylaxe im Bereich des inneren Genitales durch Seprafilm®.
-
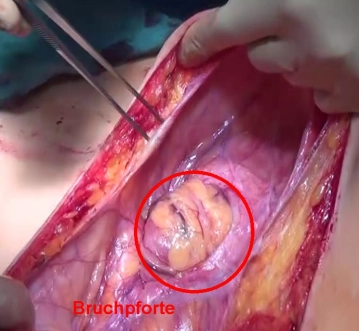
Befund
![Befund]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann. -
Hautschnitt und Darstellung der Bruchpforte
![Hautschnitt und Darstellung der Bruchpforte]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Der Zugang erfolgt über eine mediane Hautinzision proximal der Bruchpforte über dem Oberbauch beginnend bis unterhalb des Nabels, welcher wie üblich links umschnitten wird. Die Subkutis wird mittels E-Messer durchtrennt, wobei es über dem Oberbauch aufgrund der Ausdünnung der Bauchdecken bereits zu einer Eröffnung des Peritoneums resp. Bruchsacks kommt. Darstellung der Bruchpforte, bei der es sich um einen großen Mittelliniendefekt handelt, der für die Hand des Operateurs problemlos durchgängig ist.
-
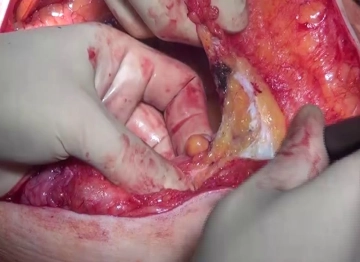
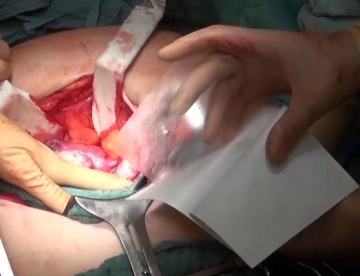
Präparation der Bruchpforte
![Präparation der Bruchpforte]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Damit die Bruchpforte sicher versorgt und Netzrandrezidive durch inkomplette Abdeckung vermieden werden können, muss eine entsprechend weite Überlappung des Defekts durch die Netzprothese erfolgen. Hierzu wird im Filmbeispiel zunächst am proximalen Defektpol die Faszie dargestellt. Bruchsack und Subkutis werden senkrecht durchtrennt und dann zu beiden Seiten hin von der Faszie präpariert. Die freiliegende Faszie wird sodann im Verlauf der Linea alba ca. 5 cm weit nach proximal eingekerbt. Anschließend erfolgt die Durchtrennung der Faszie ausgehend vom distalen Defektpol, hier über eine Länge von ca. 15 cm, da sich palpatorisch eine Gitterhernie andeutet. Es erfolgt die Eventration des Dünndarms, bei der keine Adhäsionen gefunden werden und auf deren Darstellung im Filmclip verzichtet wird.
-
Adhäsionsprophylaxe im kleinen Becken mit Seprafilm®
![Adhäsionsprophylaxe im kleinen Becken mit Seprafilm®]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Zur Prophylaxe von Verklebungen und Verwachsungen wird das innere Genital komplett mit Seprafilm® umhüllt, wozu im Film insgesamt 3 Membranen (15 × 13 cm/1 Membran sowie 7,5 × 13 cm/2 Membranen) verwendet werden.
Bei der Platzierung der Seprafilm®-Membran ist zu beachten:
Die sterile Umverpackung der Seprafilm®-Membran sollte 10 – 15 Minuten vor der Verwendung der Menbran geöffnet werden, damit sie etwas Feuchtigkeit aufnehmen kann.
Das Operationsfeld muss trocken sein.
Die Membran sollte nur mit trockenen Handschuhen bzw. Instrumenten berührt werden.
Vor dem Anbringen der Membran am „Zielobjekt“ darf kein Kontakt mit Gewebeoberflächen erfolgen. Bei unerwünschtem Kontakt kann durch die vorsichtige Applikation einer Spüllösung (z. B. physiologischer NaCl-Lösung) die Membran wieder behutsam von der Gewebeoberfläche abgelöst werden.
Zur Positionierung kann die Membran ca. 2 cm aus ihrer umgebenden Hülle herausgezogen werden und sodann mit einem trockenen Handschuh oder Instrument an das „Zielobjekt“ angedrückt und gleichzeitig die Hülle zurückgezogen werden.
Die Membran kann mit etwas Spülflüssigkeit (wenige ml) befeuchtet werden, damit sie sich leichter an das Gewebe bzw. die Organkonturen anpasst.
Die von der Hülle umschlossene Membran kann im Bedarfsfall mit einer Schere auf die gewünschte Größe zugeschnitten werden.
Bei der Verwendung mehrerer Membranen wie im Filmbeispiel sollen sich die einzelnen Membranen 2 – 3 cm überlappen, damit eine einwandfreie Abdeckung gewährleistet ist.
Nach der Platzierung ist eine zusätzliche Fixierung der Membran – z. B. durch Nähte – nicht erforderlich.
Die Präparation der linken Seite wird demonstriert. Es erfolgt zunächst die Resektion des Bruchsack
Jetzt freischalten und direkt weiter lernen.
Einzelfreischaltung
Freischaltung dieses Lehrbeitrags für 3 Tage.
Beliebtestes Angebot
webop - Sparflex
Kombiniere flexibel unsere Lernmodule und spare bis zu 50%.
87,34 $/ jährliche Abrechnung
Allgemein- und Viszeralchirurgie
Alle Lehrbeiträge in diesem Modul freischalten.
174,70 $ / jährliche Abrechnung