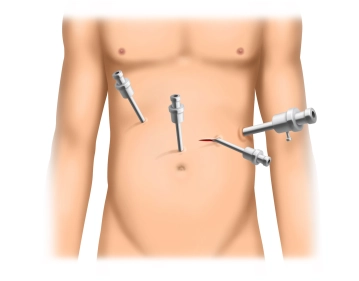
Nach kurzer Inzision im lateralen Mittelbauch links erfolgt durch einen 12mm-Einmaltrokar mit Optikfunktion der Zugang zum Abdomen unter Sichtkontrolle.
Anschließend werden drei 5mm-Trokare bogenförmigförmig oberhalb der Nabelebene in den Ober- bzw Mittelbauch eingebracht. Ein weiterer 5mm-Trokar (wie im Beispiel) kann optional hoch epigastrisch platziert werden.
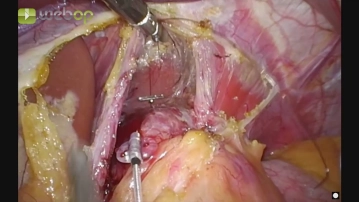
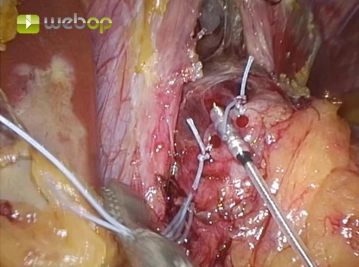
Mit einem fächerförmigen Retraktor wird der linke Leberlappen hochgehalten und so der gastroösophageale Übergang zugänglich gemacht.