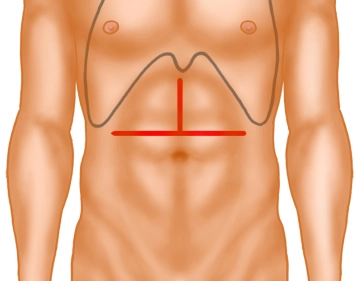
Die Eröffnung des Abdomens erfolgt über eine Oberbauchquerlaparotomie mit oberer Medianlaparotomie, sogenanntes “umgekehrtes T“.
Dann wird mittels Diathermie das Subkutangewebe und anschließend die Rektusmuskulatur auf der Holzrinne durchtrennt.
Die eröffnete Bauchhöhle wird nun exploriert, um Lage und Ausdehnung des Tumors und somit die Resektabilität nach Ausschluß von Fernmetastasen, insbesondere an Peritoneum und Leber, beurteilen zu können. Der Tumor ist im mittleren Drittel des Magens an der großen Kurvatur gelegen.
-
Quere Oberbauchlaparotomie
![Quere Oberbauchlaparotomie]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann. -
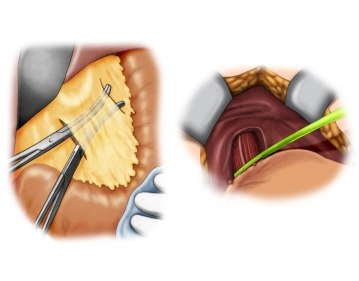
Absetzen des kleinen Netzes; Präparation des gastroösophagealen Überganges
![Absetzen des kleinen Netzes; Präparation des gastroösophagealen Überganges]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Nach Lösen von pericholezystischen Verklebungen wird das Omentum minus lebernah von distal nach proximal unter Schonung des Ligamentum hepatoduodenale abgesetzt. Die Präparation setzt sich dann auf den gastroösophagealen Übergang fort. Der abdominale Ösophagus wird zirkulär freigelegt und angeschlungen.
-
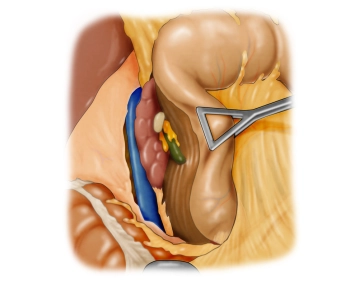
Mobilisation nach Kocher
![Mobilisation nach Kocher]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Nun erfolgt die Mobilisation des Duodenums nach Kocher. Dabei wird das paraduodenale Peritoneum circa 1 cm vom lateralen Rand entfernt inzidiert und das Duodenum von dorsal in einer weitgehend gefäßfreien Schicht vom Retroperitoneum abgehoben und die Vena cava dargestellt.
-
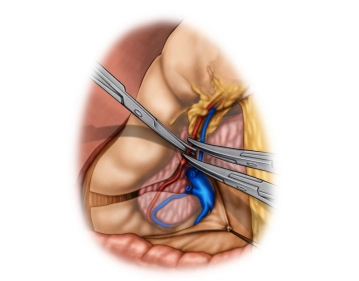
Präparation am Ligamentum hepatoduodenale
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Beginn der Lymphknotendissektion am Ligamentum hepatoduodenale (LK-Gruppe 12), dabei wird die Arteria gastrica dextra abgangsnah durchtrennt und die A. hepatica communis angezügelt.
-
Absetzen des großen Netzes und der gastroepiploischen Gefäße
![Absetzen des großen Netzes und der gastroepiploischen Gefäße]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Durch die Abpräparation des Omentum majus vom Colon transversum wird die Bursa omentalis vollständig eröffnet. Dabei wird das große Netz an der großen Kurvatur belassen. Als nächstes werden die rechtsseitigen gastroepiploischen Gefäße zwischen Overholt-Klemmen zentral abgesetzt.
Bemerkung: Zur vollständigen Mobilisation des Magens werden später auch die kurzen Magengefäße vom Magenfundus zur Milz sowie an der Hinterwand des Magens kleinere Gefäße und auch eine ggf. vorhandene A. gastrica posterior durchtrennt bzw. ligiert, ebenso die Pars densa des Omentum minus.
Nun wird das proximale Duodenum zirkulär präpariert und anschließend mit einem linearen Nahtgerät c
Jetzt freischalten und direkt weiter lernen.
Einzelfreischaltung
Freischaltung dieses Lehrbeitrags für 3 Tage.
Beliebtestes Angebot
webop - Sparflex
Kombiniere flexibel unsere Lernmodule und spare bis zu 50%.
87,34 $/ jährliche Abrechnung
Allgemein- und Viszeralchirurgie
Alle Lehrbeiträge in diesem Modul freischalten.
174,70 $ / jährliche Abrechnung
TachoSil® wird bei Erwachsenen und Kindern ab einem Alter von 1 Monat zur unterstützenden Behandlun
Jetzt freischalten und direkt weiter lernen.
Einzelfreischaltung
Freischaltung dieses Lehrbeitrags für 3 Tage.
Beliebtestes Angebot
webop - Sparflex
Kombiniere flexibel unsere Lernmodule und spare bis zu 50%.
87,34 $/ jährliche Abrechnung
Allgemein- und Viszeralchirurgie
Alle Lehrbeiträge in diesem Modul freischalten.
174,70 $ / jährliche Abrechnung