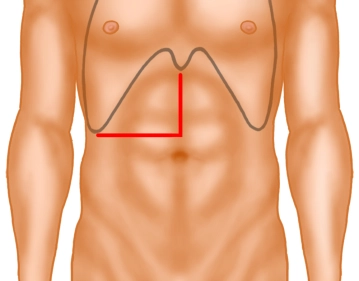
Laparotomie durch Oberbauch-Rechtwinkelschnitt unter subtiler Blutstillung; quer im rechten Oberbauch, median nach cranial bis zum Xiphoid; Exploration des Abdomens, Umlegen der Wundränder und Einsetzen des Retraktionsgerätes.
-
Laparotomie
![Laparotomie]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann. -
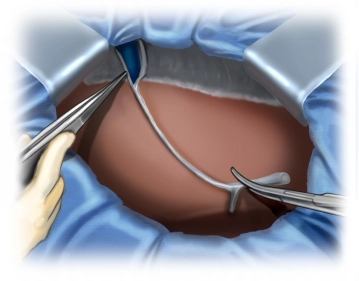
Durchtrennung des Ligamentum falciforme hepatis
![Durchtrennung des Ligamentum falciforme hepatis]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Nach Ausschluss extrahepatischer Metastasen, Durchtrennung des Ligamentum falciforme hepatis.
-
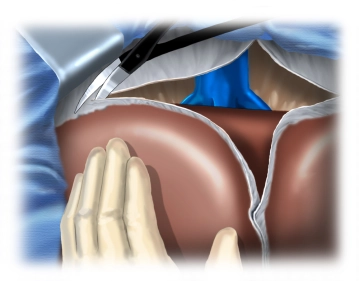
Mobilisation der Leber
![Mobilisation der Leber]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Durchtrennung des Ligamentum triangulare dextrum; Mobilisation der Leber aus den Verklebungen zum Zwerchfell mit Darstellung des Venensterns
-
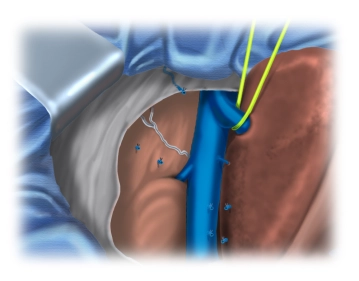
Präparation der Vena cava inferior
![Präparation der Vena cava inferior]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Mobilisation der Leber auch von caudal; die retrohepatische Vena cava inferior wird präpariert und die hier einmündenden Venen werden durch Clips oder Durchstechungen versorgt; Anzügeln der rechten Lebervene.
-
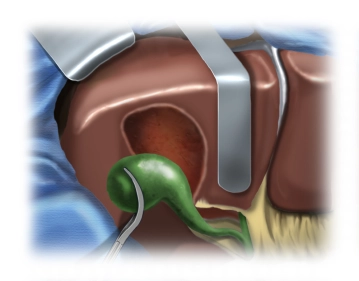
Auslösen der Gallenblase
![Auslösen der Gallenblase]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Nach Exploration des Leberhilus erfolgt die anterograde Auslösung der Gallenblase.
Untersuchung der Leber und Überprüfung des präoperativen Befundes hinsichtlich Gefäßanatomie, Tumor
Jetzt freischalten und direkt weiter lernen.
Einzelfreischaltung
Freischaltung dieses Lehrbeitrags für 3 Tage.
Beliebtestes Angebot
webop - Sparflex
Kombiniere flexibel unsere Lernmodule und spare bis zu 50%.
87,34 $/ jährliche Abrechnung
Allgemein- und Viszeralchirurgie
Alle Lehrbeiträge in diesem Modul freischalten.
174,70 $ / jährliche Abrechnung
TachoSil® wird bei Erwachsenen und Kindern ab einem Alter von 1 Monat zur unterstützenden Behandlun
Jetzt freischalten und direkt weiter lernen.
Einzelfreischaltung
Freischaltung dieses Lehrbeitrags für 3 Tage.
Beliebtestes Angebot
webop - Sparflex
Kombiniere flexibel unsere Lernmodule und spare bis zu 50%.
87,34 $/ jährliche Abrechnung
Allgemein- und Viszeralchirurgie
Alle Lehrbeiträge in diesem Modul freischalten.
174,70 $ / jährliche Abrechnung