-
Vorwort des Operateurs
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann. -
Anlage des Pneumoperitoneums und Platzieren des Optiktrokars
![Anlage des Pneumoperitoneums und Platzieren des Optiktrokars]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
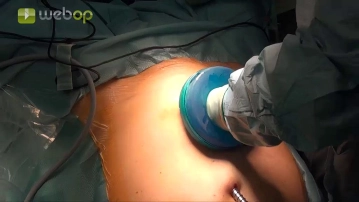
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Über eine Inzision zwischen Xyphoid und Nabel Einführen der Verresnadel und druckkontrolliertes Anlegen des Pneumoperitoneums. Sodann Einführen eines Optik-Schraubtrokars (T1) sowie der 30 °-Optik.
Prof. Berger erläutert in diesem Schritt die Möglichkeiten zur Platzierung des Handports:
1. Pfannenstielschnitt
Vorteil: Bessere Kosmetik
Nachteil: Die in situ befindliche Hand kann bei der Mobilisation des Sigmas stören, da ihr Aktionsradius deutlich eingeschränkt ist und sie mehr oder weniger permanent über dem Sigma „schwebt“.2. Mediane Laparotomie knapp unterhalb des Nabels
Vorteil: Der Aktionsradius der eingeführten Hand ist wesentlich größer, reicht von der linken Flexur bis hinab ins Becken und behindert nicht die Mobilisation des Sigmas.
Nachteil: Ggf. störende Narbenbildung über dem Unterbauch. -
Platzieren des 1. Arbeitstrokars
![Platzieren des 1. Arbeitstrokars]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
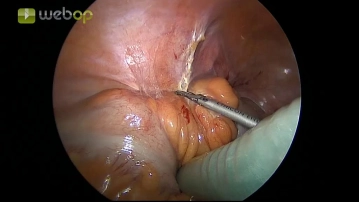
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Ein 12 mm-Trokar (T2) wird 2 Querfinger oberhalb der rechten Spina iliaca anterior superior platziert. Es schließt sich die übliche diagnostische Laparoskopie zur Inspektion der Abdominalhöhle an, auf deren Darstellung im Filmbeispiel verzichtet wird.
Tipps:
- Zur systematischen Exploration gehört die Inspektion aller 4 Quadranten der Abdominalhöhle, meist unter Zuhilfenahme einer stumpfen Fasszange, die über den ersten Arbeitstrokar eingeführt wird.
- Ggf. ist eine Lagerveränderung des Patienten erforderlich (Trendelenburg-, Anti-Trendelenburg-Lagerung, Links-, Rechtskippung).
-
Platzieren des Handports
![Platzieren des Handports]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Im Filmbeispiel wird das GelPort® Laparoscopic System von Applied Medical verwendet.
Mit Hilfe der beiliegenden Schablone wird die Länge der Inzision entsprechend der Handschuhgröße des Operateurs festgelegt und markiert.Bemerkung: Die Anwendung der Schablone wird an einem Pfannenstielschnitt demonstriert.
Für die hier gezeigte Operation wählt der Operateur einen vertikal verlaufenden Zugang knapp unterhalb des Nabels. Nach dem Eröffnen der Bauchhöhle wird der Handport, der aus einem Retraktor mit integriertem Schutz der Bauchdecke und einer GelSeal® Kappe besteht platziert. Dabei muss sicher gestellt werden, dass der grüne Ring ohne Interposition von Darm dem Peritoneum flach anliegt. Durch Aufrollen des Retraktors nach innen wird der Port der Bauchwanddicke angepasst und gleichzeitig gespannt. Durch Aufsetzen der Kappe ist jetzt ein gasdichter Zugang zum Bauchraum geschaffen.
-
Mobilisation des Sigmas von lateral
![Mobilisation des Sigmas von lateral]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Mit der eingeführten Hand wird das Sigma nach medial gespannt und die links seitlichen Verwachsungen (postentzündlich, fetal) mittels Ultracision (eingeführt über T2) durchtrennt und das Sigma schrittweise entlang der parakolischen Rinne in der gefäßfreien Schicht zwischen Mesosigma und Gerota-Faszie mobilisiert. Identifikation des linken Ureters dorsal der intakten Gerota-Faszie.
Tipps:
- Die Präparation wird durch die Trendelenburg-Lagerung („kopftief“) des Patienten bei gleichzeitiger Rechtskippung des OP-Tischs erleichtert.
- Man beachte bei der Präparation nicht nur die enge Nachbarschaft zum linken Ureter, sondern auch zu den Gonadengefäßen.
Proximal des Promontoriums wird das Mesosigma von medial mittels Ultracision inzidiert und digital
Jetzt freischalten und direkt weiter lernen.
Einzelfreischaltung
Freischaltung dieses Lehrbeitrags für 3 Tage.
Beliebtestes Angebot
webop - Sparflex
Kombiniere flexibel unsere Lernmodule und spare bis zu 50%.
86,75 $/ jährliche Abrechnung
Allgemein- und Viszeralchirurgie
Alle Lehrbeiträge in diesem Modul freischalten.
173,50 $ / jährliche Abrechnung