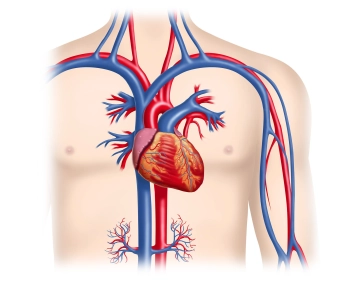
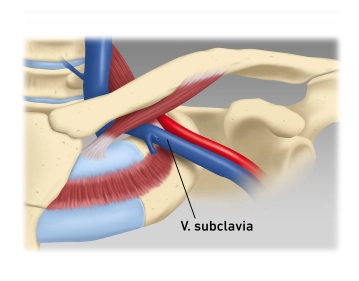
Nach Hautdesinfektion und steriler Abdeckung erfolgt die Lokalanästhesie im Verlauf des linken Sulcus deltoideopectoralis sowie im Bereich der Aggregattasche. Ca. 6-7 cm lange Hautinzision über dem Sulcus und Durchtrennung der Subkutis mittels eines Elektromessers. Nach Einsetzen eines Wundspreizers und subtiler Blutstillung mit bipolarer Koagulation erfolgt die Präparation der Aggregattasche.
Tipps
- Die Präparation der Aggregattasche sollte stumpf, d. h. digital durchgeführt werden, um Blutungen zu vermeiden.
- Empfehlenswert ist die Position der Tasche über der Mitte des M. pectoralis major, bei der eine spätere Aggregatdislokation in die Axilla selten beobachtet wird.
- In den meisten Fällen werden Schrittmacher-Aggregate subkutan positioniert. Bei kaum vorhandener Subkutis (Kinder, untergewichtige Patienten) ist die prämuskuläre Platzierung wegen der Gefahr einer Drucknekrose der Haut („innerer Dekubitus“) nicht ratsam.
- Lokalanästhetika: Man beachte die maximal zulässige Höchstmenge, die je nach Konzentration variiert und zwischen 20 und 80 ml liegt. Auf den Zusatz von Vasokonstriktoren sollte verzichtet werden. Betäubt wird nur die Haut, nicht die Subkutis, da hier keine Schmerzfasern verlaufen.