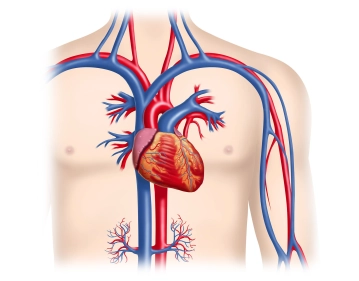
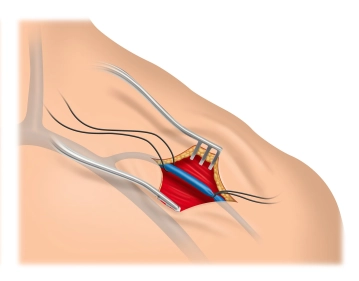
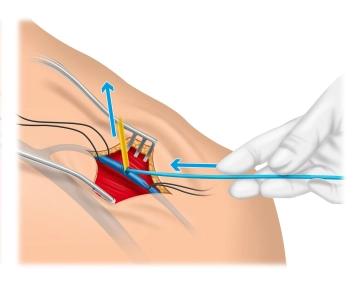
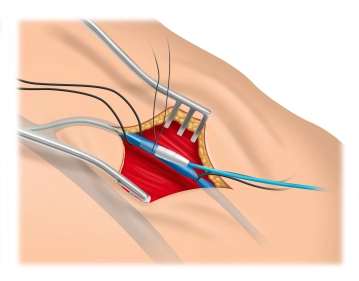
Zu Beginn dieses OP-Schritts ist es bei Schraubelektroden ratsam, die Funktion der korkenzieherartigen Wendel zu überprüfen, indem sie mittels des Drehmechanismus ausgefahren und vollständig wieder zurückgedreht wird. Nach der Eröffnung der V. cephalica zwischen den Haltefäden – im 30° Winkel sollte sie zur Hälfte inzidiert werden – wird zur Erleichterung der Sondeneinführung der sog. „Schuh“ über die Inzision eingeführt (gehört mit zum Lieferumfang des Defibrillator-Sets). Da sich die Sonde nur wenige Zentimeter vorschieben lässt, wird im Filmbeispiel mit einem Einführungsbesteck gearbeitet.
Unter Durchleuchtung wird die korrekte Positionierung der Sondenspitze im Apex des re. Ventrikels kontrolliert, anschließend wird sie durch Ausfahren der Wendel im Trabekelwerk des Myokards verankert. Nach der Positionierung erfolgt das „Durchmessen“ der Sonde, mit der die diversen Parameter wie Detektions- und Stimulationsschwellen usw. ermittelt werden, die Rückschlüsse auf die korrekte Position und Funktion der Sonde zulassen.
Tipps
1. Beim Einführen der Sonde in das Gefäß wird ihre Gleitfähigkeit verbessert, indem sie z. B. mit NaCl-Lösung angefeuchtet wird.
2. Das Vorschieben der Sonde kann gelegentlich an einem von kranial in die V. cephalica einmündenden Ast scheitern, indem die Sonde in diesen Ast abgleitet oder aber, die Sonde lässt sich nicht über den Einmündungswinkel zwischen V. cephalica und V. subclavia manövrieren. Das Problem tritt im Filmbeispiel auf und lässt sich mit einem der Seldinger-Technik-ähnlichen Manöver beseitigen:
Anstelle der Sonde wird ein Seldingerdraht über die V. cephalica eingeführt und vorgeschoben, was in der Regel mühelos gelingt, da er wesentlich flexibler ist als die rigide Defibrillatorsonde. Über den liegenden Draht wird ein dilatatorähnliches Einführungsbesteck unter gleichzeitiger manueller Fixierung des Drahtes vorgeschoben. Nach Entfernung des Drahtes und des Dilatator-Inlays erfolgt die Einführung der Defibrillatorsonde über den Dilatator, der anschließend in einer Peel-Technik entfernt wird.
3. Arbeitet man wie im Filmbeispiel mit einem Seldingerdraht, der beim Vorschieben partout nicht den Eingang zur V. subclavia findet, sollte eine Hilfsperson den Arm des Patienten nach kaudal ziehen, während man den Draht mehrfach vor- und zurückzieht.
4. Lässt sich der Seldingerdraht vorschieben, nicht aber das Einführungsbesteck, ist eine Sondenimplantation über die V. cephalica nicht möglich und es muss die V. subclavia punktiert werden. Den Seldingerdraht sollte man während dieses Manövers in situ belassen, er kann für die Punktion der V. subclavia unter Durchleuchtung als Leitstruktur bei der Orientierung hilfreich sein.
5. Hat die Sonde die Tendenz, beim Vorschieben in die V. cava inferior zu gleiten, sollte man versuchen, die Sondenspitze an der lateralen Wand des re. Vorhofs „abzustützen“. Sodann wird der Sondenmandrin einige Zentimeter zurückgezogen und die Sonde bei manuell fixiertem Mandrin erneut vorgeschoben, wodurch sich eine Sondenschlaufe bildet, die sich nach und nach über die Trikuspidalklappe in den re. Ventrikel legt. Das Manöver sollte solange fortgeführt werden, bis die Schlaufe die Ausflussbahn des re. Ventrikels oder den Hauptstamm der Pulmonalarterie erreicht hat. Nachdem man sich durch kurze Durchleuchtung vergewissert hat, das der Sondenmandrin bis über die Trikuspidalklappe vorgeschoben ist, zieht man mit der einen Hand die in der Ausflussbahn befindliche Sonde zurück, während die andere Hand den Mandarin fixiert. Durch dieses Manöver „fällt“ die Sondenspitze schließlich auf den Boden des Ventrikels und verankert sich unter simultanem Vorschieben von Sonde und Mandrin im Trabekelwerk.
6. Bei korrekter Platzierung der Sonde im re. Ventrikel erkennt man diese unter Durchleuchtung an einem leicht s-förmigen Sondenverlauf, die Sondenspitze liegt ca. 2-3 Querfinger medial des li. Herzschattens.
7. Das typische Zeichen für eine feste Verankerung der Sondenspitze ist ein regelmäßiges, systolisches „Abwärts-Nicken“ der Spitze.
8. Die feste Verankerung der Sondenspitze kann bei Eingriffen in Lokalanästhesie geprüft werden, indem der Patient aufgefordert wird, mehrmals tief einzuatmen und zu husten.