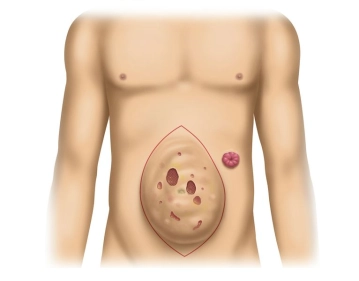
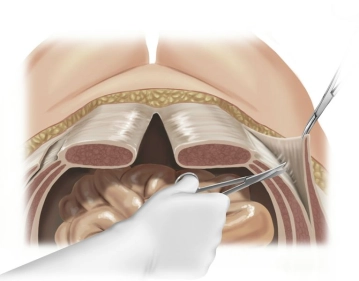
Zustand nach medianer Laparotomie mit Sigmaresektion und Anlage eines endständigen Colostomas (Hartmann- Situation). Jetzt progedientes Narbenhernienrezidiv mit Hautulzeration und teilweise freiliegendem Netz nach mehrfachen Therapieversuchen zuletzt mit Implantation eines nichtresorbierbaren Netzes in Onlaytechnik.
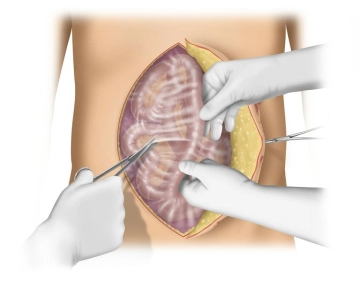
Nach Konditionierung der Bauchdecken durch ein präoperatives progressives Pneumoperitoneum (s. Sublay offen Perioperatives Management) wird in der hier beschriebenen Technik eine erneute Hernien- Reparation vorgenommen. Die dem Patienten angebotene AP-Rückverlagerung mit Wiederanschluss des Colons wurde nicht gewünscht.
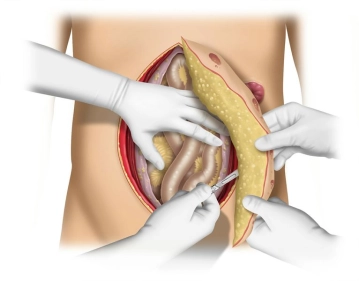
Bei potentiell infizierten Situs ist zur Hernienreparation die Verwendung eines biologischen Netzes indiziert.
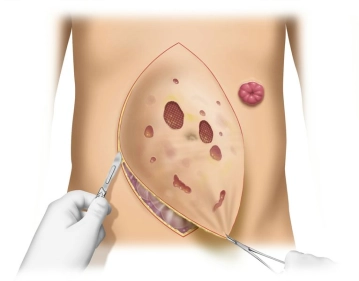
Zunächst Markierung der Schnittführung, anschließend beginnt die Hautinzision rechts lateral. Diese wird im Verlauf des Eingriffs sukzessive zu einer kompletten Umschneidung des Bruchsacks und Exzision der ulzerierten und ausgedünnten Hautareale vervollständigt.