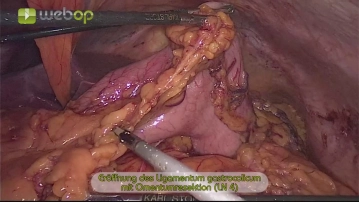
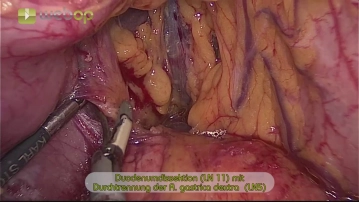
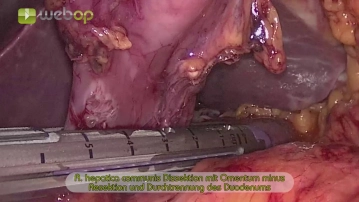
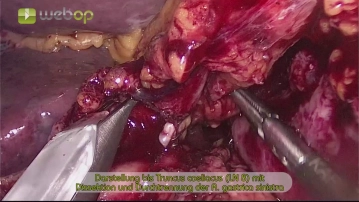
Der Eingriff beginnt mit der Markierung der Trokarpositionen auf der Bauchdecke. Nach Einbringen der Veressnadel und druckkontrollierter CO2-Insufflation werden in halbkreisförmiger Anordnung folgende Trokare platziert:
- T1 = 10 mm-Optiktrokar
- T2 = 10 mm-Arbeitstrokar
- T3 = 5 mm-Arbeitstrokar (später 12 mm für CEEA-Stapler und Erweiterungsinzision zur Präparatbergung)
- T4 = 12 mm-Arbeitstrokar
- T5 = 5 mm-Arbeitstrokar