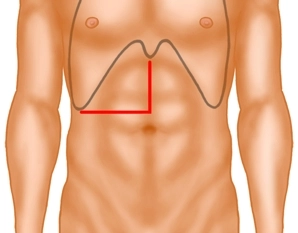
Die Laparotomie erfolgt über eine mediane Inzision mit Erweiterung in die rechte Flanke, wobei bei die Schnittführung knapp oberhalb des Nabels in die rechte Flanke abweicht. Dann Durchtrennung der rechtsseitigen Rektusmuskulatur mittels bipolarer Schere und Eröffnen des Peritoneums. Der Schnitt kann links neben dem Xiphoid vorbeigeführt werden: Dadurch gewinnt man noch eine gute Strecke, die die Einsicht, insbesondere zu den Lebervenen erleichtert.
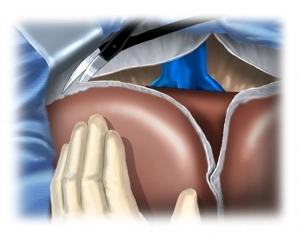
Anschließend wird das Lig. falciforme hepatis bauchdeckennah abgesetzt. Nach Umlegen der Wundränder erfolgen das Einsetzen des Bauchdeckenretraktors und Inspektion des Situs: Ausschluss extrahepatischer Metastasen oder auffällig große Lymphknoten im Hilus bei primären Leberkarzinomen; im gezeigten Fall besteht eine Leberzirrhose.
Anmerkung:
Kleine Eingriffe am linken Leberlappen bis hin zu links-lateralen Resektionen können auch über eine mediane Laparotomie, Keilexzisionen aus den inferioren Segmenten IVb, V und VI über einen Rippenbogenrandschnitt vorgenommen werden.