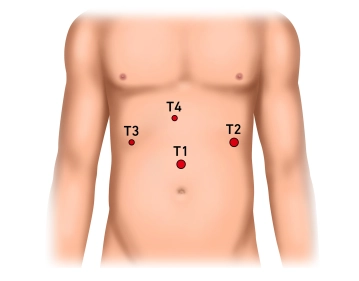
Über eine Hautinzision zwei bis drei Querfinger oberhalb des Nabels Einbringen der Verresnadel und druckkontrolliertes Anlegen des Pneumoperitoneums bis 13 mm Hg. Einbringen eines 10er Sicherheitstrokars. Einführen der Optik und Exploration des Oberbauchs: es imponiert ein entzündlicher Konglomerattumor; der linke Leberlappen ist kranial mit dem Zwerchfell und nach kaudal mit Magen und Omentum majus verklebt.
-
Anlegen des Pneumoperitoneums, Einbringen des Optiktrokars und Exploration des Oberbauchs
![Anlegen des Pneumoperitoneums, Einbringen des Optiktrokars und Exploration des Oberbauchs]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann. -
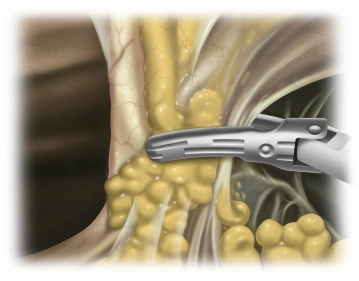
Einbringen der ersten Arbeitstrokare und Absetzen des Lig. teres hepatis und des Lig. falciforme
![Einbringen der ersten Arbeitstrokare und Absetzen des Lig. teres hepatis und des Lig. falciforme]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Unter endoskopischer Sicht Einbringen eines 12er Trokars im linken Oberbauch sowie eines 5er Trokars in gleicher Höhe im rechten Oberbauch. Das Lig. teres hepatis und das Lig. falciforme hepatis werden mit dem UltraCision Harmonic Scalpel® bauchdeckennahe abgesetzt.
-
Mobilisation der Leber
![Mobilisation der Leber]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Die Mobilisation des linken Leberlappens ist wegen der entzündlichen Veränderungen erheblich erschwert. Dabei müssen Adhäsionen zum Zwerchfell bis zur Mobilisation der linken Lebervene schrittweise gelöst werden. Aufgrund der flächigen Verwachsungen ist das Lig. triangulare als solches nicht zu identifizieren. Der Magen und das Omentum minus sind ebenfalls flächig an der Facies viszeralis des linken Leberlappens adhärent. Ablösen des Magens von der Leberunterfläche mit Mobilisation des Leberhilus und Eröffnen des kleinen Netzes bis hinauf zum Zwerchfell.
-
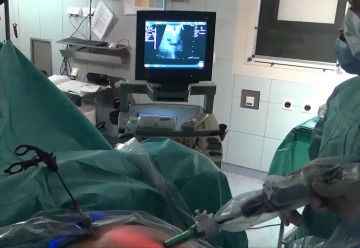
Lokale Befunderhebung: Intraoperative Sonographie (IOUS)
![Lokale Befunderhebung: Intraoperative Sonographie (IOUS)]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Austauschen des 12er Oberbauchtrokars links gegen einen 15er Trokar und hierüber Einführen der Ultraschallsonde. Der IOUS erlaubt sowohl die Detektion zusätzlicher Tumorbefunde als auch die Beurteilung der intrahepatischen Gefäßverläufe. Dies erlaubt Rückschlüsse auf die Resektabilität, eine Abschätzung des möglichen Sicherheitsabstandes zur Leberläsion und ist somit eine wichtige Hilfe für die Wahl der Resektionsgrenzen. Im Filmbeispiel kommt bei der Untersuchung ein Thrombus innerhalb eines Pfortaderastes zur Darstellung.
-
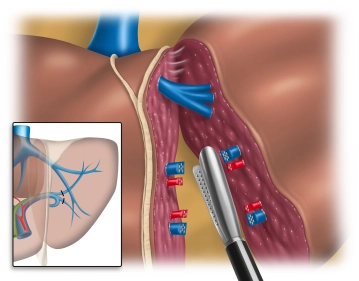
Beginn der Parenchymdissektion; Absetzen der Pfortaderversorgung und der Arterie
![Beginn der Parenchymdissektion; Absetzen der Pfortaderversorgung und der Arterie]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Die Parenchymdurchtrennung erfolgt entlang dem linken Rand des Lig. falciforme von der vorderen Kante bis zur Mündungsebene der linken Lebervene.
Bemerkung: Es ist wichtig, dass die Transsektionslinie auf der linken Seite des Ligaments bleibt, um eine Verletzung der Pedikel (Ast der Vena porta, der Arteria hepatica und des Ductus hepaticus) zu Segment 4 zu vermeiden.
Mit Hilfe eines breiten laparaskopischen Retraktors (Endo Paddle Retract™, 12 mm Instrument, subxiphoidaler Zugang) werden die den Tumor tragenden lateralen Segmente nach links gezogen.Das Parenchym wird mit dem Ultracisiongerät durchtrennt, zunächst die Parenchymbrücke zwischen Segment 4 und 3. Die Segment-Hilusdissektion basal erfolgt mit Stapeln des Pedikels (abwinkelbares Klammernahtgerät, blaues Magazin)
Tipp: Bei der Bedienung des Ultracision ist darauf zu achten, dass die Schere ganz langsam geschlossen und nicht mit Kraft zugedrückt wird, weil sonst keine ausreichende Koagulation erzielt werden kann. Bei weichem Parenchym kann auch der Wasserstrahldissektor sehr gut eingesetzt werden; sein Vorteil ist die geringere Aerosol Bildung im Vergleich zum Ultracision.
Man kommt jetzt weiter in das Parenchym hinein und kann dann sukzessive entlang der Segmentgrenzen
Jetzt freischalten und direkt weiter lernen.
Einzelfreischaltung
Freischaltung dieses Lehrbeitrags für 3 Tage.
Beliebtestes Angebot
webop - Sparflex
Kombiniere flexibel unsere Lernmodule und spare bis zu 50%.
86,75 $/ jährliche Abrechnung
Allgemein- und Viszeralchirurgie
Alle Lehrbeiträge in diesem Modul freischalten.
173,50 $ / jährliche Abrechnung
... - Operationen aus der Allgemein-, Viszeral- und Transplationschirurgie, Gefässchirurgie und Th
Jetzt freischalten und direkt weiter lernen.
Einzelfreischaltung
Freischaltung dieses Lehrbeitrags für 3 Tage.
Beliebtestes Angebot
webop - Sparflex
Kombiniere flexibel unsere Lernmodule und spare bis zu 50%.
86,75 $/ jährliche Abrechnung
Allgemein- und Viszeralchirurgie
Alle Lehrbeiträge in diesem Modul freischalten.
173,50 $ / jährliche Abrechnung