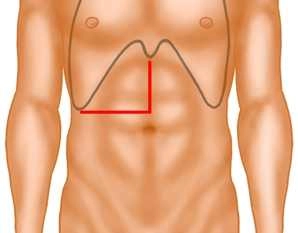
Rechtwinklige Laparotomie quer im rechten Oberbauch, median nach cranial bis zum Xiphoid (sog. J-Hautschnitt).
-
Hautschnitt
![Hautschnitt]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann. -
Eröffnung des Abdomens
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Nach Eröffnung der Haut erfolgt die Durchtrennung der Subkutis bis Darstellung der Faszien. Im Bereich der medianen Laparotomie wird die Linea alba eröffnet. Im Bereich der queren Laparotomie wird zuerst das vordere Blatt der Rektusscheide eröffnet, danach die quere Muskulatur und am Ende das hintere Blatt der Rektusscheide zusammen mit dem Peritoneum.
Nach Eröffnung des Abdomens erfolgt die Adhäsiolyse.
-
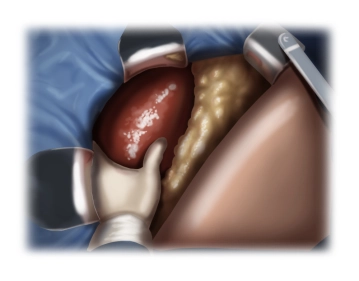
Exploration
![Exploration]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Nach Exploration des Abdomens erfolgt die Umlegung der Wundränder und Einsetzen des Bauchdeckenretraktors.
-
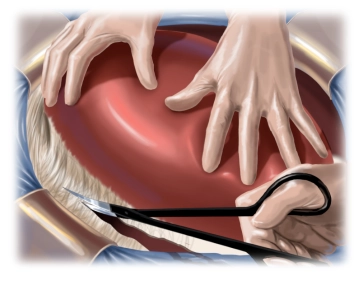
Mobilisation
![Mobilisation]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Durchtrennung des Ligamentum teres hepatis (Rest der obliterierten linken Nabelvene). Durchtrennung des rechten Ligamentum triangulare unter Schonung der Lebervenen. Komplette Mobilisation des rechen Leberlappens mit Darstellung der Vena cava inferior. Manuelle Palpation des Tumors.
-
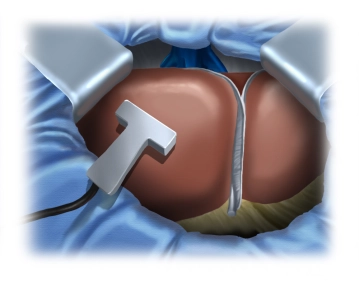
Intraoperative Sonographie
![Intraoperative Sonographie]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Intraoperative Sonographie mit Darstellung des Tumors und der anatomischen Grenzen des Lebersegmentes 6 (rechte Lebervene, Ast der Vena cava, s. auch Anatomie). Dann Festlegung und Markierung der Resektionsgrenzen unter Sonographiekontrolle mit dem Elektrokauter.
Anterograde Cholezystektomie mit Darstellung der Arteria cystica und des Ductus cysticus. Die Arter
Jetzt freischalten und direkt weiter lernen.
Einzelfreischaltung
Freischaltung dieses Lehrbeitrags für 3 Tage.
Beliebtestes Angebot
webop - Sparflex
Kombiniere flexibel unsere Lernmodule und spare bis zu 50%.
87,34 $/ jährliche Abrechnung
Allgemein- und Viszeralchirurgie
Alle Lehrbeiträge in diesem Modul freischalten.
174,70 $ / jährliche Abrechnung
TachoSil® wird bei Erwachsenen und Kindern ab einem Alter von 1 Monat zur unterstützenden Behandlun
Jetzt freischalten und direkt weiter lernen.
Einzelfreischaltung
Freischaltung dieses Lehrbeitrags für 3 Tage.
Beliebtestes Angebot
webop - Sparflex
Kombiniere flexibel unsere Lernmodule und spare bis zu 50%.
87,34 $/ jährliche Abrechnung
Allgemein- und Viszeralchirurgie
Alle Lehrbeiträge in diesem Modul freischalten.
174,70 $ / jährliche Abrechnung