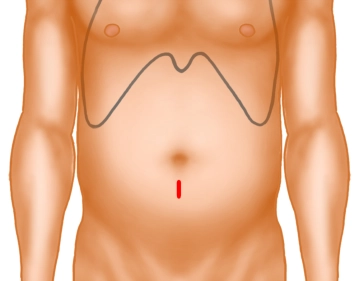
Nach sterilem Abwaschen und Abdecken des OP-Gebietes erfolgt zunächst die Mini-Laparotomie unmittelbar unterhalb des Nabels. Anlage des Pneumoperitoneums über die Verresnadel.
-
Minilaparotomie
![Minilaparotomie]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann. -
Positionierung der Trokare
![Positionierung der Trokare]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Einbringen eines 11-er Optiktrokars; Platzieren der weiteren 11-er Arbeitstrokare links lateral (Arbeitstrokar z.B. für die Schere) und im Epigastrium (Arbeitstrokar z.B. für eine Greifzange). Ein 5-er Trokar wird im rechten oberen Quadranten platziert (Arbeitstrokar für z.B. den Sauger).
-
Exploration
![Exploration]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
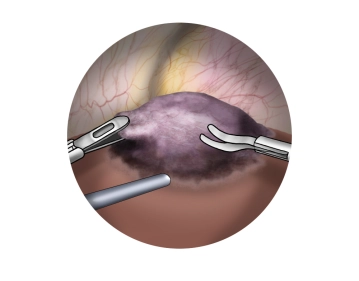
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Darstellen der Zyste, Eröffnen der Zyste mit der Schere durch Elektrokoagulation. Absaugen des Zysteninhaltes.
Tipps: Für die Exzision der Zystenwand kann je nach Dicke und Beschaffenheit eine Schere mit monopolarem oder bipolarem Strom, oder sogar das Ultracision verwendet werden.
Auf eine sorgfältige Blutstillung ist dabei zu achten!
Tiefer gelegene Zysten (z.B. bei polyzystischer Erkrankung) können bläulich erscheinen und müssen von Venen unterschieden werden; hier kann ein laparoskopischer Ultraschall mit Gefäß-Dopplerfunktion hilfreich sein! -
Zirkuläre Exzision der Zystenwand
![Zirkuläre Exzision der Zystenwand]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
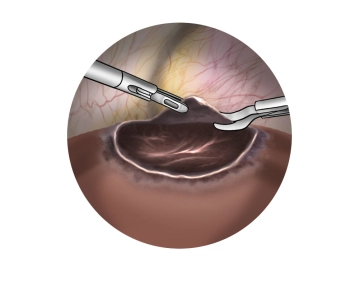
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Entdachung der Zyste durch zirkuläre Exzision mit der monopolaren Schere am Zystenrand. Inspektion der Zystenwand auf neoplastische Veränderungen.
Kontrolle des Zytsengrunds auf Blutungen oder Galleaustritt; ggf. Gefäßkoagulation, resp. Clipping
Jetzt freischalten und direkt weiter lernen.
Einzelfreischaltung
Freischaltung dieses Lehrbeitrags für 3 Tage.
Beliebtestes Angebot
webop - Sparflex
Kombiniere flexibel unsere Lernmodule und spare bis zu 50%.
87,34 $/ jährliche Abrechnung
Allgemein- und Viszeralchirurgie
Alle Lehrbeiträge in diesem Modul freischalten.
174,70 $ / jährliche Abrechnung