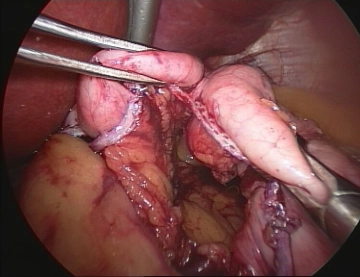
Nach Operationsbeginn (Anlage des Kapnoperitoneums, der Platzierung der Arbeitstrokare, der Inspektion der Bauchhöhle) erfolgt die Darstellung des His-Winkels.
Anschließend wird mit der Magenpouchbildung im Bereich der kleinen Kurvatur 2 cm unterhalb des ösophagokardialen Überganges begonnen. Die A. gastrica sinistra versorgt den Magenpouch und wird beachtet, um Blutungskomplikationen zu vermeiden und die Durchblutung des Pouches zu garantieren. Die Durchtrennung des Magens erfolgt zunächst in horizontaler Richtung mit linearen Klammernahtinstrumenten (Klammerhöhe 3,5 mm).
Die Dissektion wird dann in Dreiecksform in Richtung auf den linken Zwerchfellschenkel fortgesetzt. Als anatomische Ziellinie dient der linke Crus des Zwerchfells.
Der Fundus sollte vollständig abgetrennt werden, um den Produktionsort des Enterohormons Ghrelin aus der Nahrungspassage auszuschließen und eine spätere Dilatation zu vermeiden.
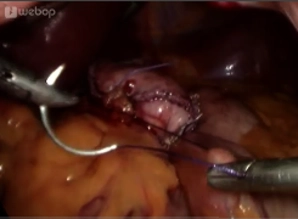
Abschließend sollte eine suffiziente Blutstillung an der Klammernahtreihe mit Ultraschall durchgeführt werden.