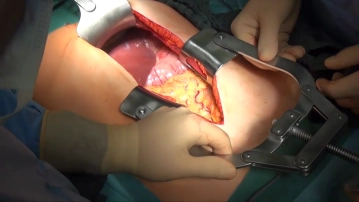
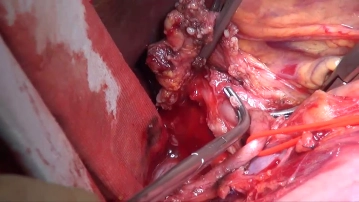
Eröffnung des Abdomens durch einen Oberbauchmedianschnitt, der mit einer Linksumschneidung des Nabels nach kaudal verlängert wird. Nach Einsetzen von Bauchdeckenretraktror und -spreizer erfolgt die Exploration der Bauchhöhle mit Beurteilung von Sitz und Ausdehnung des Primärtumors, des Lymphknotenbefalls und von Organmetastasen.
-
Zugang
![Zugang]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann. -
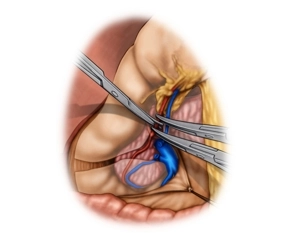
Ablösung des großen Netzes; Absetzen der gastroepiploischen Gefäße
![Ablösung des großen Netzes; Absetzen der gastroepiploischen Gefäße]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Das Omentum majus wird hochgeschlagen und mit dosiertem Zug gegen das Colon transversum angespannt. Das Omentum majus wird unmittelbar am Oberrand des Querkolons abpräpariert und die Bursa omentalis eröffnet.
Nach Mobilisierung der rechten Kolonflexur und der Pars descendens duodeni, so wie vorsichtigem Trennen des rechtsseitig mit dem Mesocolon verklebten großen Netzes, erfolgt die Absetzung der hier eintretenden gastroepiploischen Gefäße. Dabei wird die V. gastroepiploica dextra vor der Mündung in die V. mesenterica sup. und die gleichnamige Arterie am Abgang aus der A. gastroduodenalis durchtrennt. -
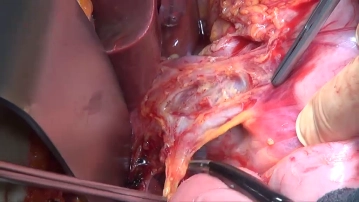
Lymphadenektomie I (Lig. hepatoduodenale/Station 12 und 13)
![Lymphadenektomie I (Lig. hepatoduodenale/Station 12 und 13)]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Die Lymphadenektomie (LAD) beginnt am Leberhilus, umfasst das Lig. hepatoduodenale und wird entlang der A. hepatica communis bis zum Truncus coeliacus fortgesetzt.
Nach Durchführung der Cholecystektomie, auf deren Darstellung hier verzichtet wird, erfolgt mit bipolarer Schere die lebernahe Inzision des Omentum minus, die linkslateral des Lig. hepatoduodenale beginnt und bis in Höhe der Kardia fortgeführt wird. Anheben des Bindegewebes mitsamt der darin enthalten Lymphknoten (LK) über der A. hepatica communis am linken Rand des Lig. hepatoduodenale mittels Pinzette und Darstellung der Arterie. Schrittweises Lösen des LK-Gewebebündels (Station 12) über der V. portae und dem Ductus choledochus. Durch Einführen des Zeigefingers in das Foramen Winslowii können mit Daumen und Zeigefinger die Aa. hepatica communis et propria, V.portae und ggf. suspekte Lymphknoten palpiert werden. Dann Ausräumen der LK-Station 13 zwischen Pankreaskopf und V. cava.
-
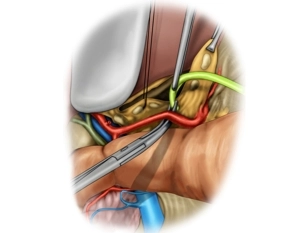
Lymphadenektomie II (A. hepatica communis/Station 8)
![Lymphadenektomie II (A. hepatica communis/Station 8)]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Die A. gastrica dextra wird zwischen Overholtklemmen durchtrennt und ligiert. Nach Anschlingen der A. hepatica propria wird das LK-Gewebebündel (Station 8) nach kraniomedial gezogen und schrittweise mittels der bipolaren Schere entlang der A. hepatica communis in Richtung auf den Truncus coeliacus in toto abpräpariert, wobei die Dissektion unmittelbar an der Adventitia der Gefäße erfolgen muss, da die Lymphknoten dieser anliegen. Das Anschlingen der A. hepatica communis mit einem Vessel- Loop vereinfacht die Präparation. Die dorsale Grenze der LK-Dissektion ist die Vorderseite der V.cava inferior.
-
Lymphadenektomie III (Truncus coeliacus/Station 9)
![Lymphadenektomie III (Truncus coeliacus/Station 9)]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Die Abgänge der A. hepatica communis und der A. lienalis aus dem Truncus coeliacus werden wie vorbeschrieben dargestellt und vom LK-Gewebebündel befreit. Mit dem stammnahen Absetzen der A. gastrica sinistra und der Abgabe des LK-Gewebebündels ist die LAD komplett. Der Ursprung des Tr. coeliacus und die Aorta werden nicht freipräpariert.
Durch eine an der großen Kurvatur angelegten Organfasszange wird der Magen dosiert nach kranial gez
Jetzt freischalten und direkt weiter lernen.
Einzelfreischaltung
Freischaltung dieses Lehrbeitrags für 3 Tage.
Beliebtestes Angebot
webop - Sparflex
Kombiniere flexibel unsere Lernmodule und spare bis zu 50%.
87,34 $/ jährliche Abrechnung
Allgemein- und Viszeralchirurgie
Alle Lehrbeiträge in diesem Modul freischalten.
174,70 $ / jährliche Abrechnung
TachoSil® wird bei Erwachsenen und Kindern ab einem Alter von 1 Monat zur unterstützenden Behandlun
Jetzt freischalten und direkt weiter lernen.
Einzelfreischaltung
Freischaltung dieses Lehrbeitrags für 3 Tage.
Beliebtestes Angebot
webop - Sparflex
Kombiniere flexibel unsere Lernmodule und spare bis zu 50%.
87,34 $/ jährliche Abrechnung
Allgemein- und Viszeralchirurgie
Alle Lehrbeiträge in diesem Modul freischalten.
174,70 $ / jährliche Abrechnung