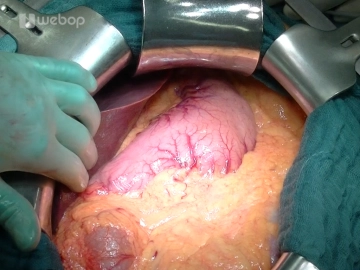
Eröffnung des Abdomens über eine quere Oberbauchlaparotomie ca. 3-4 Querfinger unterhalb des Rippenbogens mit Durchtrennung von Kutis, Subkutis, ventralem Faszienblatt, M. rectus abdominis und dorsalem Faszienblatt/Peritoneum. Das Ligamentum teres hepatis wird zwischen Klemmen durchtrennt und mit Durchstechungsligaturen (Vicryl® 2-0) versorgt. Das Ligamentum falciforme wird mittels monopolarem Strom bis hoch über die Leber reichend gelöst. Nach Umlegen der Bauchdecken mit feuchten Bauchtüchern wird das Rahmenhakensystems bestehend aus einem Bauchdeckenrahmen und einem Seilzughakensystem wie dem Ulmer Retraktor eingesetzt. Anschließend erfolgt die systematische Exploration der Bauchhöhle: Leber (Filiae?), Magen (Tumor?, Lage der Magensonde), Dünndarm (Adhäsionen?, Peritonealkarzinomatose?), Kolonrahmen (Tumor?), Omentum majus (Adhäsionen?, Peritonealkarzinomatose?).
-
Quere Oberbauchlaparotomie
![Quere Oberbauchlaparotomie]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann. -
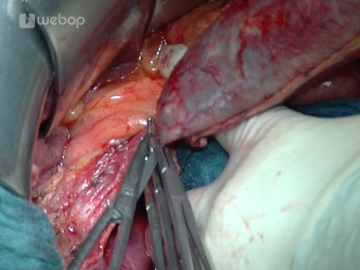
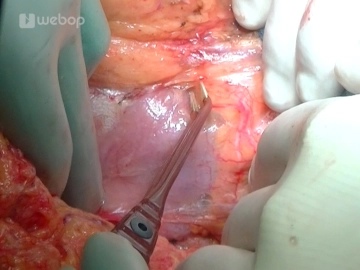
Antegrade Cholecystektomie
![Antegrade Cholecystektomie]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Die Resektionsphase beginnt mit der Cholecystektomie: Fassen der Gallenblase und antegrade Mobilisation aus dem Leberbett mittels Bipolarpinzette und Schere, Darstellung von Ductus cysticus und A. cystica, welche jeweils mit einer Overholtklemme gefasst, anschließend durchtrennt und mit einer Durchstechungsligatur (Prolene® 3-0) versorgt werden. Nach Absetzen und Abgabe der Gallenblase erfolgt eine Abstrichentnahme aus dem Gallesekret.
-
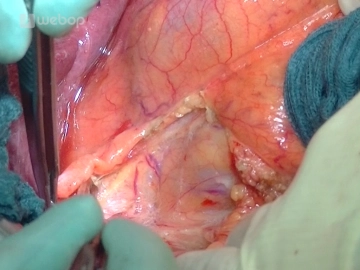
Mobilisation der rechten Kolonflexur/Kocher-Manöver
![Mobilisation der rechten Kolonflexur/Kocher-Manöver]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Zur Mobilisation der rechten Kolonflexur wird der Peritonealumschlag lateral des Colon ascendens inzidiert und die Inzision bis um die rechte Flexur herum fortgeführt. Durch sanften Zug am Colon spannt sich die gefäßlose Bindegewebsschicht dorsal des Colons an und das Mesokolon kann vom Retroperitonealraum, von der Vorderfläche des Duodenums und des Pankreaskopfes abgelöst werden.
Die Mobilisation des Duodenums erfolgt nach Kocher: der mobilisierte Kolonabschnitt wird zur linken Seite verlagert und das Duodenum nach Inzision entlang seiner Außenkante mittels Bipolarpinzette und Präparierschere zusammen mit dem Pankreaskopf aus seinen retroperitonealen Verbindungen gelöst. Die Mobilisation des Pankreaskopfes wird über die Aortenebene hinweg bis zum Treitzschen Band fortgeführt, damit der Pankreaskopf von dorsal komplett umfasst bzw. palpiert werden kann (Tumorgröße? Konsistenz?).
-
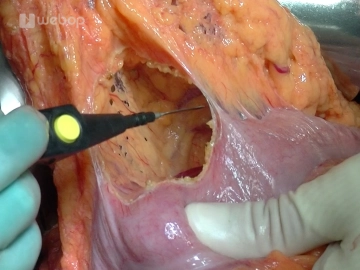
Eröffnung der Bursa omentalis
![Eröffnung der Bursa omentalis]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Eingehen in die Bursa omentalis, indem das Omentum von der rechten Kolonflexur bis zum linken Drittel des Colon transversum abgelöst wird. Die Bursa omentalis ist leicht verklebt, kann aber mit der bipolaren Pinzette gut befreit und dargestellt werden. Nun kann das Pankreas auch nach linksseitig gut exploriert werden.
-
Darstellung des Pankreasunterrandes und der mesenterico-portalvenösen Gefäßachse
![Darstellung des Pankreasunterrandes und der mesenterico-portalvenösen Gefäßachse]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Fortsetzen der Präparation am Pankreasunterrand mit Darstellung der V. mesenterica superior und der V. portae. Dabei werden die Venen des Pankreaskopfes mittels des LigaSure® oder zwischen Durchstechungsligaturen (Prolene® 4-0 oder 5-0) durchtrennt. Das Pankreas kann nun von kaudal beginnend auf Ebene der V. mesenterica superior/V. portae untertunnelt und an seinem Unterrand links und rechts der V. portae mit Haltefäden versehen werden.
Cave: Blutungen aus der Pfortader! -möglichst wenig Zug auf dem Gewebe!
Nach Eröffnung des Omentum minus und Darstellung der A. hepatica communis am Pankreasoberrand erfol
Jetzt freischalten und direkt weiter lernen.
Einzelfreischaltung
Freischaltung dieses Lehrbeitrags für 3 Tage.
Beliebtestes Angebot
webop - Sparflex
Kombiniere flexibel unsere Lernmodule und spare bis zu 50%.
87,34 $/ jährliche Abrechnung
Allgemein- und Viszeralchirurgie
Alle Lehrbeiträge in diesem Modul freischalten.
174,70 $ / jährliche Abrechnung