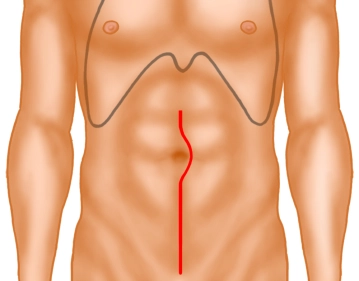
Mediane Laparotomie, beginnend an der Symphyse bis einige Zentimeter oberhalb des Nabels. (Es ist sehr wichtig, darauf zu achten, dass der Hautschnitt tatsächlich bis zur Symphyse geführt wird, da sonst der Zugang ins Becken erheblich erschwert wird). Sofern nötig etwas Mobilisation der Blase. Einbringen einer Umlegung (Folie) und eines Sperrers. Intraoperative Befunderhebung.
-
Hautschnitt und Exposition
![Hautschnitt und Exposition]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann. -
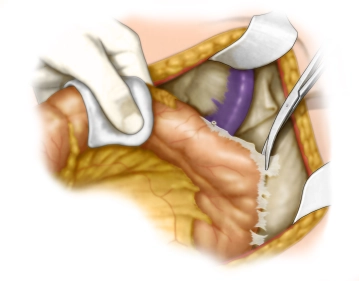
Mobilisation der linken Flexur
![Mobilisation der linken Flexur]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Die Mobilisation der linken Flexur erfolgt abwechselnd von aboral durch Abpräparation des Colon descendens in einer avaskulären Schicht vor der linken Niere und von oral durch Ablösen des großen Netzes vom Dickdarm bis etwa zur Mitte des Querkolons mit Eröffnung der Bursa omentalis. Zuletzt werden die Verbindungen zu Milz und Pankreas gelöst.
-
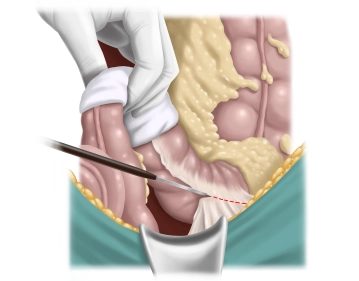
Auslösen des Sigmas von lateral
![Auslösen des Sigmas von lateral]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Das Kolon wird nach medial gezogen und die lateralen Verklebungen mit dem Peritoneum lateral zur Bauchwand scharf durchtrennt. Hierbei ist sorgfältig darauf zu achten, dass die Präparation nicht zu tief, also bis auf den Psoas und hinter die Niere erfolgt, sondern nur das Mesosigma mobilisiert wird. Der Ureter wird dann automatisch dorsal zu liegen kommen und kann identifiziert werden. Eine Freilegung im Sinne einer Ureterolyse ist nicht erforderlich.
-
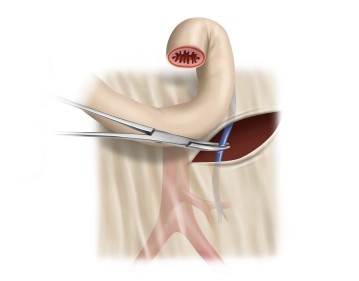
Durchtrennung der V. mesenterica inferior
![Durchtrennung der V. mesenterica inferior]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Eröffnen des Mesokolons von zentral unter dem duodeno-jejunalen Übergang (Treitzsches Band). Dabei lässt sich die Vena mesenterica inferior nahe des Pankreasunterrandes freigelegen und zwischen Overholtklemmen durchtrennen.
-
Durchtrennung der A.mesenterica inferior
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Nun wird die A. mesenterica inferior aufgesucht, indem das Peritoneum an der Basis des Mesosigmas am Übergang zum Mesorektum in Höhe des Promontoriums zunächst inzidiert wird. In einem ventralen Abstand von etwa 1cm zur Aorta und parallel zu dieser wird nach kranial präpariert, bis die A. mesenterica inferior identifiziert werden kann. Um im Abgangsbereich der Arterie befindliche Nervenfasern zu schonen, wird das Gefäß etwa 1–2cm distal seines Ursprungs aus der Aorta, aber proximal des Abgangs der A. colica sinistra unter Mitnahme der zentralen Lymphknoten durchtrennt.
Tipp: Das zentrale Absetzen der A. mesenterica inferior ist onkologisch beim Rektumcarcinom nicht zwingend gefordert. Gegenüber einem selektiven Absetzen der A .rectalis superior unter Erhalt der A. colica sinistra lässt sich aber eher eine spannungsfreie Anastomose anlegen, weshalb dieses Vorgehen trotz der potentiellen Nachteile (schlechtere Durchblutung, Schädigung der präaortalen Nerven) meist favorisiert wird.
Bemerkung: Eine primäre Gefäßdurchtrennung ist a priori onkologisch sinnvoll, jedoch ein Vorteil durch Studien nicht belegt.
Von links lateral wird nun ins kleine Becken präpariert, indem das Beckenbodenperitoneum an der per
Jetzt freischalten und direkt weiter lernen.
Einzelfreischaltung
Freischaltung dieses Lehrbeitrags für 3 Tage.
Beliebtestes Angebot
webop - Sparflex
Kombiniere flexibel unsere Lernmodule und spare bis zu 50%.
87,34 $/ jährliche Abrechnung
Allgemein- und Viszeralchirurgie
Alle Lehrbeiträge in diesem Modul freischalten.
174,70 $ / jährliche Abrechnung