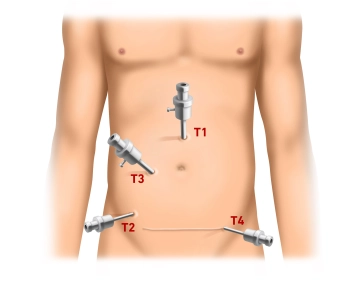
Der Eingriff beginnt mit einer Mini-Laparotomie für den Kameratrokar (T1, 10 mm) ca. 3 cm oberhalb des Nabels. Nach Einführen des Trokars druckkontrolliertes Anlegen des Pneumoperitoneums bis 13 mm Hg und Inspektion der Bauchhöhle auf evtl. Adhäsionen (Z. n. abdominaler Hysterektomie via Pfannenstielschnitt). Unter endoskopischer Sicht sukzessives Einbringen der Arbeitstrokare: T2 (5 mm) rechter Unterbauch auf Höhe der Spina iliaca anterior superior, T3 (10 mm) ungefähr mittig auf einer leicht bogenförmigen Verbindungslinie zwischen T1 und T2. Zuletzt Einbringen von T4 (5 mm) im linken Unterbauch suprasymphysär im Verlauf des späteren Pfannenstielschnittes.
-
Anlegen des Pneumoperitoneums und Trokarpositionierung
![Anlegen des Pneumoperitoneums und Trokarpositionierung]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann. -
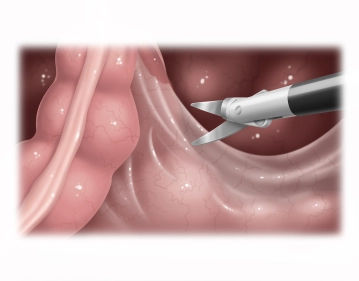
Eröffnung des rechtsseitigen Beckenperitoneums
![Eröffnung des rechtsseitigen Beckenperitoneums]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Der Operationstisch wird kopftief gekippt (Trendelenburg-Lagerung) und das Omentum majus und der Dünndarm mittels zweier atraumatischer Fasszangen in den Oberbauch bzw. rechten Mittelbauch verlagert. Unter Zug wird das Colon sigmoideum (im Filmbeispiel liegt ein beträchtliches Sigma elongatum vor) auf die linke Seite verlagert, dadurch wird das Rektum angespannt und angehoben. Nun rechtsseitiges Eröffnen des pararektalen Peritoneums ab dem Promontorium entlang der Umschlagfalte mittels bipolarer Schere (alternativ: LigaSure® oder BowaNightKnife®) nach Identifizierung von Ureter und Beckengefäßen. Der dorsale Faszienspaltraum zwischen Fascia pelvis parietalis (Waldeyersche Faszie) und Mesorektum wird soweit wie möglich eröffnet.
Anmerkungen
- Der Ureter sollte vor Beginn der Präparation identifiziert werden; es ist jedoch nicht notwendig, ihn freizupräparieren oder anzuschlingen.
- Die seitliche Aufhängung des Colon deszendens sollte erhalten bleiben, um ein späteres Absinken in das kleine Becken zu verhindern.
-
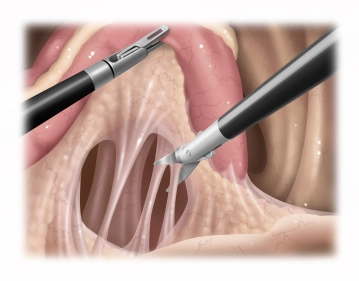
Dorsale Mobilisation des Rektums
![Dorsale Mobilisation des Rektums]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Das Rektum wird nach rechts geschlagen und das seitliche Peritoneum auf der linken Seite eingeschnitten. Anschließend erfolgt die dorsale Mobilisation des Rektums unter Schonung des Mesorektums resp. der Gefäßachse. Es wird eine Verbindung zur Gegenseite geschaffen, sodass das Rektum angehoben und die dorsale Präparation bis zum Beckenboden fortgeführt werden kann.
-
Laterale und ventrale Mobilisation des Rektums
![Laterale und ventrale Mobilisation des Rektums]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Die Inzision der ventralen Umschlagfalte und anschließende Präparation des Rektums im vorderen Faszienraum zwischen Scheidenhinterwand und Rektumvorderwand unter Respektierung der Denonvillier`schen Faszie wird durch das Einführen eines Stieltupfers in den Scheidenstumpf erleichtert (Z.n. Hysterektomie). Das Rektum wird zirkulär mobilisiert (lateral und dorsal bis zum Beckenboden) und kann dadurch weit nach kranial luxiert werden.
Anmerkungen
- Im dargestellten Fall wird das prärektale Peritoneum inzidiert und das Rektum auch ventral bis zum Beckenboden präpariert, sodass eine optimale Streckung erreicht wird.
- Der vordere Faszienraum zwischen Scheidenhinterwand und Rektumvorderwand sollte nicht zwingend präpariert werden, da es durch Präparation im ausgewalzten Douglas-Raum zu einer Schädigung der vegetativen Nervenfasern kommen kann. Manchmal muss lediglich das ventrale Peritoneum inzidiert werden, um eine ausreichende Streckung des Rektums zu erreichen.
- Es gibt Studien, die zeigen, dass der Erhalt der lateralen Ligamente das postoperative funktionelle Ergebnis verbessert bei allerdings erhöhter Rezidivrate.
-
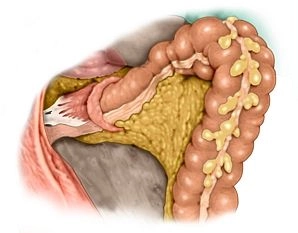
Absetzen des oberen Rektums und Dissektion des Mesosigmas
![Absetzen des oberen Rektums und Dissektion des Mesosigmas]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
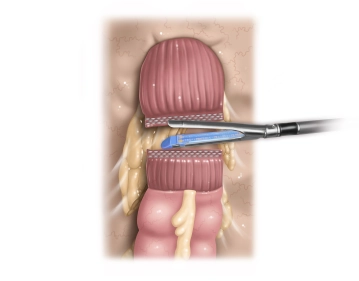
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Es zeigt sich, dass Sigma und Rektum ausreichend mobilisiert sind. Das hypermobile Sigma elongatum zeigt praktisch keine Verklebungen zur lateralen Bauchwand, sodass hier keine weitere Präparation erfolgt. Im Übergang mittleres zum oberen Rektumdrittel wird jetzt die dorsale Rektumwand darmwandnah unterfahren. Nach Kamerawechsel von T3 auf T2 (es wird nun eine 5-mm-Optik verwendet) wird der Darm mittels Endo GIA® hier durchtrennt. Hierzu wird der Trokar T1 entfernt und das Gerät über die Mini-Laparotmie eingeführt. Danach erfolgt unter Erhalt der Gefäße (A. rectalis sup.) darmnah mit dem BOWA NightKNIFE® die Dissektion des Mesosigmas soweit, dass das proximale Sigma ohne große Spannung bis zum Rektumstumpf geführt werden kann.
Anmerkungen
- Die aborale Resektionslinie sollte auf jeden Fall distal der Hochdruckzone des rektosigmoidalen Übergangs liegen, was man typischerweise am Fehlen von Appendices epiploicae und Taenien erkennen kann.
- Bei der Festlegung der proximalen Resektionslinie wird die Länge des Resektats so gewählt, dass der Darm später in einem weichen S-förmigen Bogen zum Rektumstumpf zieht.
Im Bereich des linken Unterbauches wird die Trokarinzision (T4) um etwa 4 cm nach medial erweitert.
Jetzt freischalten und direkt weiter lernen.
Einzelfreischaltung
Freischaltung dieses Lehrbeitrags für 3 Tage.
Beliebtestes Angebot
webop - Sparflex
Kombiniere flexibel unsere Lernmodule und spare bis zu 50%.
87,34 $/ jährliche Abrechnung
Allgemein- und Viszeralchirurgie
Alle Lehrbeiträge in diesem Modul freischalten.
174,70 $ / jährliche Abrechnung