Exzision der alten Oberbauch-Rechtwinkel-Laparotomie bei vorausgegangener atypischer Metastasenresektion i.B. der posterioren re-seitigen Lebersegmente. Präparation bis auf das Peritoneum und Eröffnen des Abdomens.
-
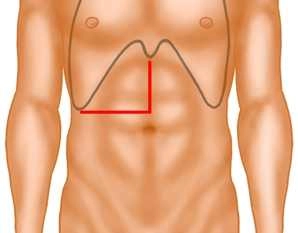
Zugang
![Zugang]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann. -
Adhäsiolyse
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Man trifft auf erhebliche Verwachsungen im Oberbauch, so dass eine Exploration des Abdomens zum Ausschlus eines extrahepatischen Tumors und einer Peirtonealcarcinose zunächst nur eingeschränkt möglich ist. Sowohl die rechte Kolonflexur als auch Dünndarmschlingen sind an der Leber adhärent und müssen Schritt für Schritt scharf abgelöst werden. Dann Umlegen der Wundränder und Einsetzen des Rektraktors.
-
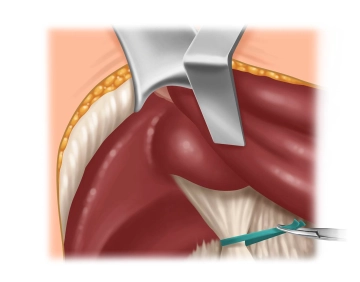
Leberhiluspräparation
![Leberhiluspräparation]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Als nächstes wird das Ligamentum hepatoduodenale aus den Vernarbungen herauspräpariert und mit einem Mersilene-Band angeschlungen. Hiermit besteht die Möglichkeit der passageren Hilusokklusion (Pringle-Manöver) bei intraoperativen Blutungskomplikationen.
Eine Lymphknotendissektion erfolgt nicht, da beim Primäreingriff schon durchgeführt und sich inspektorisch und palpatorisch keine vergrößerten Lymphknoten zeigen.
Bemerkung:
Prinzipiell ist die Lymphknotendissektion des Leberhilus beim kolorektalen Lebermetastasen empfohlen, da in Inzidenz in Abhängigkeit von Anzahl und Sitz der Metastasen mit 3-28% angegeben wird.
-
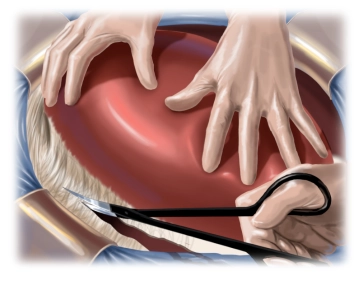
Mobilisation der Leber
![Mobilisation der Leber]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Um eine ausreichende Exposition der posterioren Segemente zu erreichen, muss die Leber komplett aus dem Retroperitoneum gelöst werden, was durch die ausgedehnten Vernarbungen nach Voroperation sehr erschwert ist. Schritt für Schritt wird die Leber aus den Verschwielungen herauspräpariert, wobei die rechte Nebenniere abpräpariert und das Zwerchfell i.B. des Tumors kleinflächig mitreseziert werden muss. Hier findet sich ein teilorganisiertes, subkapsuläres Hämatom nach Voroperation.
-
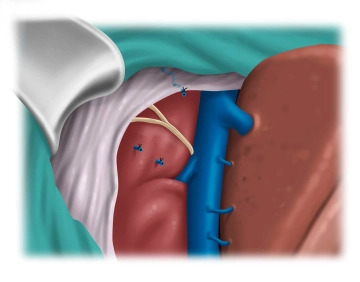
Präparation der Vena cava
![Präparation der Vena cava]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Schritt für Schritt wird nun auf die V. cava vorpräpariert. Unter Darstellung der V. cava zunächst von kranial (Venenstern) und kaudal gelingt es den rechen Leberlappen komplett zu mobilisieren.
Das subkapsuläre Hämatom wird herauspräpariert und entfernt. ... - Operationen aus der Allgemein-,
Jetzt freischalten und direkt weiter lernen.
Einzelfreischaltung
Freischaltung dieses Lehrbeitrags für 3 Tage.
Beliebtestes Angebot
webop - Sparflex
Kombiniere flexibel unsere Lernmodule und spare bis zu 50%.
87,34 $/ jährliche Abrechnung
Allgemein- und Viszeralchirurgie
Alle Lehrbeiträge in diesem Modul freischalten.
174,70 $ / jährliche Abrechnung