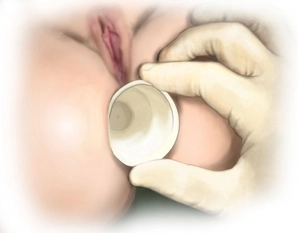
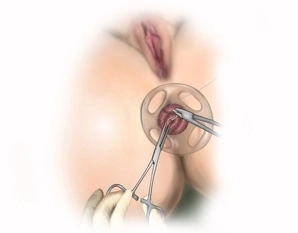
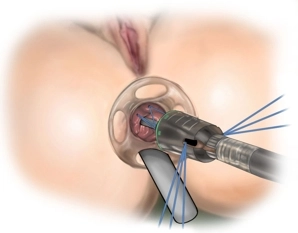
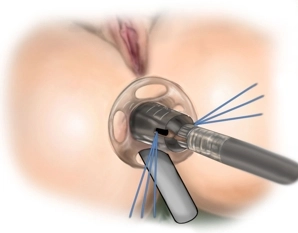
Es erfolgt die digital-rektale Untersuchung zur Validierung des Befundes und eine vorsichtige digitale Analdilatation. In der rektal-digitalen Untersuchung lässt sich die Rektozele nach ventral austasten, die vaginale Hinterwand wölbt sich in der Austastung vor. Das Ausmaß der rektoanalen Intussuszeption wird mit dem Stieltupfer und/oder einer Allis-Klemme beurteilt. Anschließend erfolgt die vorsichtige digitale Dehnung des Analsphinkters bevor der Analdilatator eingesetzt wird. Anschließend wird das durchsichtige Proktoskop als analer Port und zum Schutz des Anoderms in den Analkanal eingeführt.
Tipp
Das durchsichtige Proktoskop (Analport) kann mit vier Stichen temporär an der perianalen Haut fixiert werden.