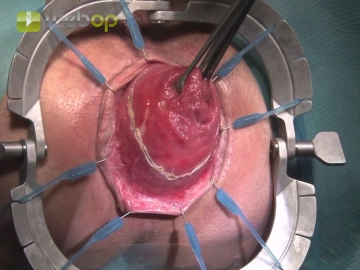
Nach kompletter äußerer Exposition des Prolapses zunächst Darstellen der Linea dentata mit Hilfe eines Lone Star- Retraktors. Anschließend unter sanftem Zug an der Spitze des Prolpases mit Allis-Klemmen zirkuläre Inzision der äußeren Rektumwandduplikatur 1-2 cm oberhalb der Linea dentata, so dass die Anastomose später proximal des M. puborectalis zu liegen kommt.
-
Einsetzen des Analretraktors; Inzision der Rektumwand
![Einsetzen des Analretraktors; Inzision der Rektumwand]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann. -
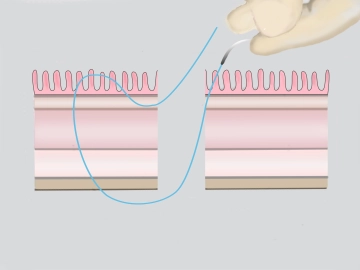
Durchtrennung der äußeren Rektumwandduplikatur
![Durchtrennung der äußeren Rektumwandduplikatur]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Die Rektumwand wird mit der bipolaren Schere schrittweise durchtrennt. Dabei werden bei jeder frei werdenden Stelle dieser Inzision die aborale Rektumwand gefasst und Rückstichnähte in Gambé-Technik vorgelegt.
Bemerkung: Mit einem geflochtenen resorbierbaren Faden der Stärke 3/0 erfolgt zunächst der Hinstich von der Submukosa nach innen, dann der Rückstich von innen nach außen allschichtig. Mit Hilfe der Fäden wird der Analring zirkulär ausgespannt. -
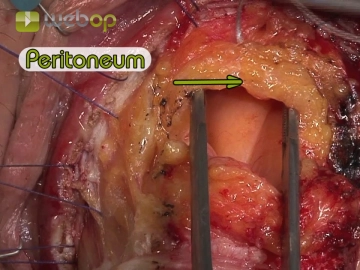
Eröffnung des Douglas-Pouches; Durchtrennung der Rektumpfeiler
![Eröffnung des Douglas-Pouches; Durchtrennung der Rektumpfeiler]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Der hernierte Douglas-Pouch stellt sich auf der vorderen Zirkumferenz der inneren Darmschlinge dar, wird eröffnet und gleichzeitig mit Nähten aus andersfarbigem Nahtmaterial versehen. Unter digitaler Kontrolle werden die seitlichen Rektumpfeiler mit den Leitungsbahnen zwischen Ligaturen durchtrennt.
-
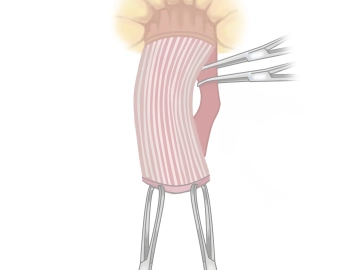
Durchtrennung des Mesorektums
![Durchtrennung des Mesorektums]()
Toneinstellungen Die Videosequenz kann mit einer automatischen Vertonung des darunter stehenden Textes abgespielt werden.
Sie können den automatischen Start der Vertonung als registrierter Nutzer in der Seitenleiste an- oder abstellen.
Bemerkung: Es handelt sich um eine Computerstimme, die nicht jeden Fachbegriff korrekt aussprechen kann.Nachpräparation des verdickten elongierten Mesorektum/Mesosigma, das anschließend zwischen Ligaturen auf Höhe der oralen Resektionsgrenze durchtrennt wird.
Als nächstes Präparation der Vaginalrückwand unter Abdrängen des präperitonealen Fetts des Douglas-
Jetzt freischalten und direkt weiter lernen.
Einzelfreischaltung
Freischaltung dieses Lehrbeitrags für 3 Tage.
Beliebtestes Angebot
webop - Sparflex
Kombiniere flexibel unsere Lernmodule und spare bis zu 50%.
87,34 $/ jährliche Abrechnung
Allgemein- und Viszeralchirurgie
Alle Lehrbeiträge in diesem Modul freischalten.
174,70 $ / jährliche Abrechnung