Adrenalektomie links, laparoskopisch - Allgemein- und Viszeralchirurgie
Sie haben keine Lizenz erworben - paywall ist aktiv: zur Produktauswahl
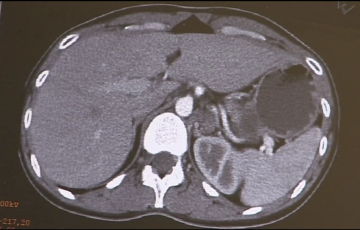
Computertomographischer Befund
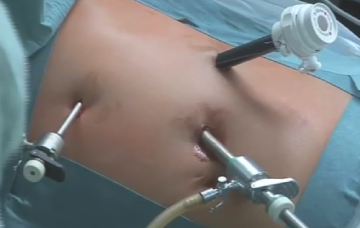
Positionierung der Trokare
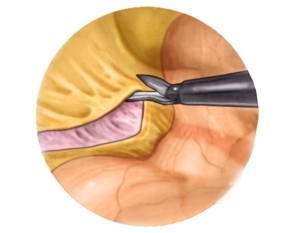
Ablösen des Colon descendens
Eröffnen des prärenalen Raums
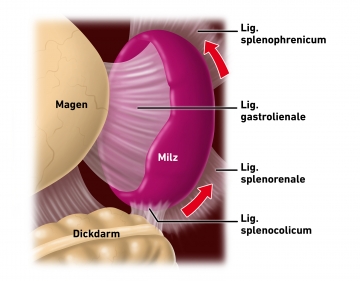
Ablösen der Milz vom Zwerchfell
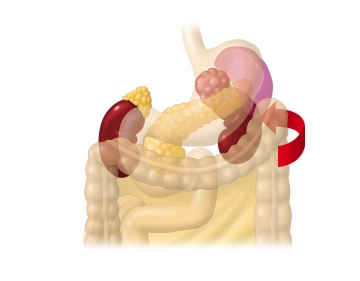
Darstellung des linken oberen Retroperitonealraums
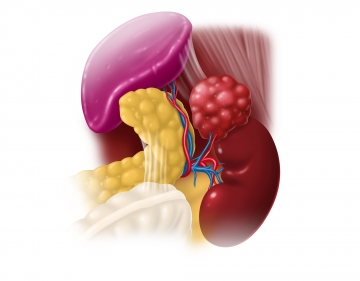
Eingang zur Nebenniere
Mobilisation des Nebennierentumors
Unterbrechung der zentralen Nebennierenvene
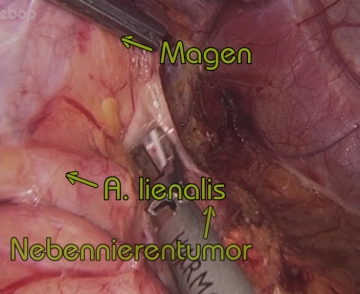
Unterbrechung der arteriellen Versorgung
Exstirpation der Nebeniere in toto
Entfernung des Präparates, Drainage
Wundverschluss
Aktualisierung vom: 01.10.2022
Publikation vom: 20.05.2012
Einzelfreischaltung
Freischaltung auf diesen Lehrbeitrag
für 3 Tage
4,99 € inkl. MwSt.

webop-Account Single
Freischaltung aller Lehrbeiträge
Preis pro Monat
für das Modul: Allgemein- und Viszeralchirurgie