Leistenhernienreparation, Lichtenstein - Allgemein- und Viszeralchirurgie
Sie haben vollen Zugriff auf diesen Inhalt.
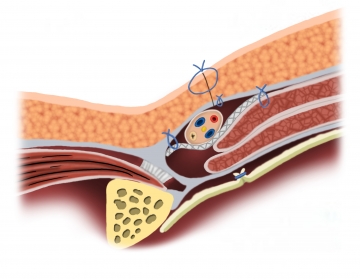
Prinzip
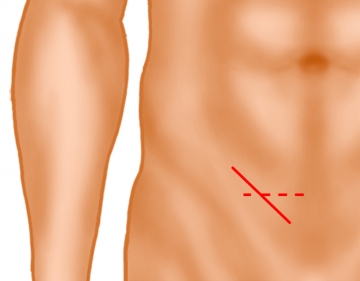
Inguinaler Hautschnitt
Es erfolgt ein ca. 5 cm langer, schräg verlaufender Hautschnitt 2 Querfinger oberhalb des Leistenbandes (durchgezogene Linie) oder alternativ eine quer verlaufende Hautinzision 2 Querfinger oberhalb des Os pubis. Hiernach Durchtrennung der Subkutis bis auf die Externus-Aponeurose. Subkutan gelegene oberflächliche epigastrische Gefäße werden ligiert (nicht dargestellt).
Bemerkung: Bei sehr adipösen Patienten oder sehr großen Skrotalhernien kann eine Verlängerung nach lateral erforderlich sein.
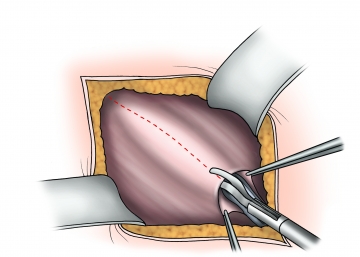
Spaltung der Externus-Aponeurose
Darstellung der Externusaponeurose sowie des äußeren Leistenrings. Inzision der Externusaponeurose im Faserverlauf am äußeren Leistenring beginnend nach lateral bis über das Niveau des inneren Leistenrings hinaus. Achtung: Unmittelbar unterhalb der Externusaponeurose verläuft der Nervus ilioinguinalis auf dem Samenstrang!
Die Faszienränder werden angeklemmt, hochgezogen und die Faszie breitflächig vom Musculus obliquus internus und Musculus cremaster unter Beachtung des Nervus hypogastricus gelöst.
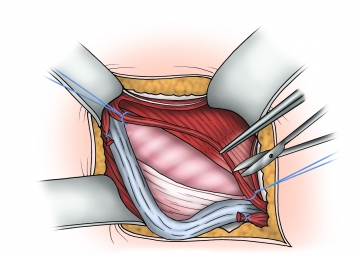
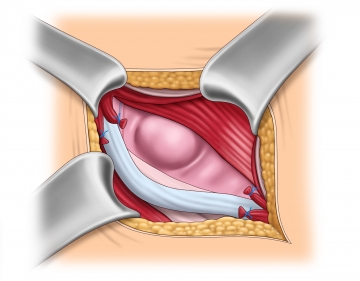
Darstellen und Anschlingen des Samenstrangs
Der Samenstrang wird ggf. gemeinsam mit einem indirekten Bruchsack zunächst in Höhe des Tuberculum pubicum frei präpariert und angeschlungen und danach komplett von der darunterliegenden Fascia transversalis bzw. einem direkten Bruchsack abgelöst.
Die Musculus cremaster-Fasern werden längs gespalten und die Samenstranggebilde identifiziert. Auf den Verlauf der Nerven und die epigastrischen Gefäße ist dabei zu achten.
Bemerkungen:
- Beim Anschlingen des Samenstrangs und Präparation des Bruchsacks muss der Ramus genitalis des Nervus genitofemoralis geschont werden, der sich am Unterrand des Samenstrangs mit den Kremasterfasern in direkter Nachbarschaft zur Vena spermatica externa erstreckt.
- Um postoperative Neuralgien zu vermeiden, ist folgendes zu beachten: Können der Ramus genitalis des Nervus genitofemoralis, der Nervus ilioinguinalis oder Nervus hypogastricus nicht geschont werden, so sind die betroffenen Nerven zu resezieren und die Resektionsenden mit einem Lokalanästhetikum zu infiltrieren.
- Langstreckige Darstellungen und Manipulationen der Nerven sollen vermieden werden. Im Zweifelsfall lieber eine Neurektomie durchführen als einen geschädigten Nerv zurücklassen.
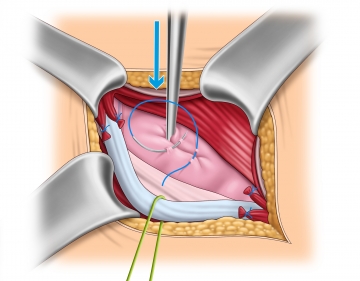
Freipräparation und Identifikation des Bruchsacks
Bruchsackversorgung – Direkte Hernie
Direkte Hernie
Bei der direkten Hernie ist eine Bruchsackeröffnung in der Regel nicht nötig. Ist der Bruchsack groß, wird dieser eingestülpt und der Bruchring entweder mit einer resorbierbaren Z-Naht umstochen oder alternativ mit einer fortlaufenden resorbierbaren Naht gerafft.
Bemerkung: Beim Lichtenstein wird die Schenkelpforte nicht inspiziert, da die Fascia transversalis nicht eröffnet wird.
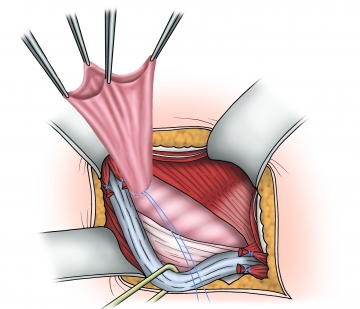
Bruchsackversorgung – Indirekte Hernie
Indirekte Hernie
Längsspaltung der Fasern des Musculus cremaster und Trennung des indirekten Bruchsacks vom Samenstrang. Liegt eine indirekte Hernie vor, muss der innere Leistenring komplett freigelegt und der Samenstrang bis hierhin verfolgt werden, um die Testikulargefäße sicher darzustellen und zu schonen, ggf. wird der Bruchsack eröffnet, aufgespannt und der Bruchinhalt reponiert.
Bemerkung: Beim ursprünglichen Lichtenstein wurde der Bruchsack nicht abgetragen, sondern nur invaginiert. Daten zeigen allerdings eine geringere Rezidivrate bei einer Abtragung des Bruchsacks, sodass dieses Vorgehen favorisiert wird.
Die Bruchsackbasis wird mit einer äußeren Tabaksbeutelnaht verschlossen, der überstehende Bruchsack reseziert. Ist ein präperitoneales Lipom vorhanden, wird dieses bis zur Basis in Höhe des inneren Leistenrings abpräpariert und über einer Ligatur abgetragen.
Tipp: Nach Resektion des überstehenden Bruchsacks sollten vor dem Kürzen der Haltefäden diese zunächst locker gehalten und die Resektionsfläche des Bruchsackstumpfes auf Bluttrockenheit kontrolliert werden. Ist eine weitere Blutstillung erforderlich, kann der Stumpf hierfür problemlos an den Haltefäden vorgezogen werden. Abschließend werden die Haltefäden gekürzt und der Stumpf versenkt bzw. dieser retrahiert sich spontan.
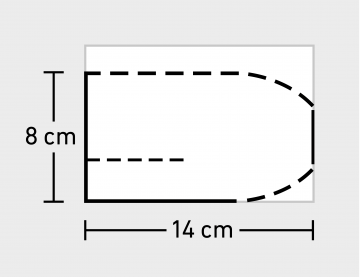
Anpassen und Zuschneiden des Netzes
Rekonstruktion mit einem großporigen nichtresorbierbaren Kunststoffnetz (Polypropylen, Polyester oder PVDF).
Ausgehend von einer Größe von 10 x 15 cm Ausschneiden eines 8 x 14 cm großen Netzes mit lateralem Schlitz und angeschrägten Enden (sofern nicht bereits vorgefertigt vorhanden als sog. Lichtensteinnetz).
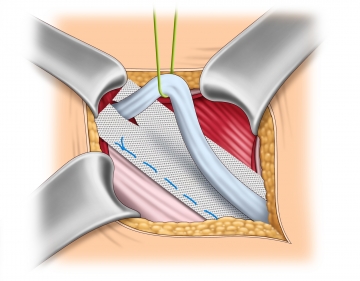
Netzfixierung am Leistenband
Die Fixation des Netzes am Unterrand des Leistenbands beginnt medial am Tuberculum pubicum. Wichtig ist, dass das Tuberculum pubicum mit mindestens 2 cm Netz nach medial überdeckt wird, da hier die meisten Rezidive auftreten. Die Netzunterkante wird bis ca. 2 cm lateral des inneren Leistenrings mit einer nichtresorbierbaren fortlaufenden Naht (monofil 2-0) an das Leistenband genäht. Wichtig ist hierbei aufgrund der Rezidivgefahr, keine Lücken am Leistenband zu lassen.
Bemerkung 1: Die Fixation sollte nicht an das Periost reichen. Cave schmerzhafte Periostitis!
Bemerkung 2: Eine Netzfixierung ist prinzipiell auch ohne Naht möglich. Verwendung finden selbsthaftende Netze sowie die Verklebung des Netzes mittels Fibrin oder Cyanoacrylat. Die Studienlage zeigt allerdings keine Reduzierung postoperativer chronischer Schmerzen.
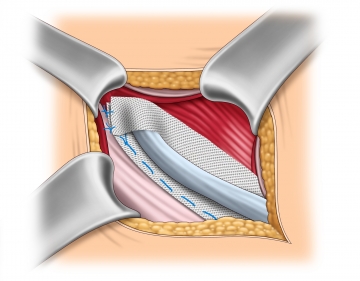
Neubildung des inneren Leistenrings
Die obere Lefze des Netzes wird am inneren Leistenring über den Samenstrang auf die untere Lefze geschlagen. Zunächst werden die beiden Lefzen miteinander vernäht (2-0, nicht resorbierbar) und anschließend mit ein oder zwei weiteren Nähten des gleichen Nahtmaterials am Leistenband fixiert.
Bemerkung: Die exakte Kalibrierung des Samenstrangdurchtritts ist zur Vermeidung von chronischen Schmerzen und Rezidiven von großer Bedeutung. Der neu gebildete innere Leistenring sollte für eine Kornzange, aber nicht für den Zeigefinger durchgängig sein.
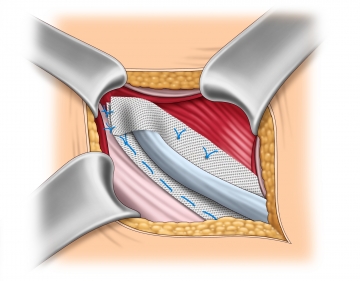
Netzfixierung am M. obliquus internus
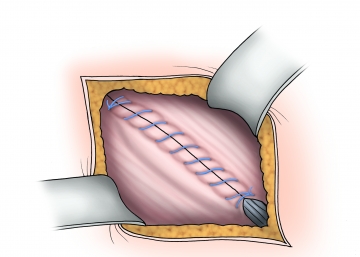
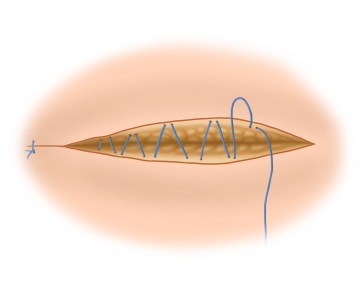
Verschluss der Externus-Aponeurose
Die Externus-Aponeurose wird mit einer fortlaufenden resorbierbaren Naht (geflochten, resorbierbar, 2-0) verschlossen und damit auch die Vorderwand des Leistenkanals rekonstruiert.
Je nach Situs kann eine Redondrainage eingelegt werden, insbesondere bei „blutigen“ Operationen und Patienten unter therapeutischer Antikoagulaion.Beenden der Operation