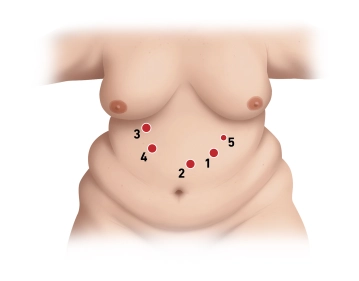
Die Position des Kameratrokars ist im linken Oberbauch, ca. 2-3 Querfinger unterhalb des linken Rippenbogens in der Medioclavicularlinie.
Der Zugang erfolgt durch einen Optiktrokar (12mm Xcel Trokar) unter Kamerasicht. Während des Einführens ist die Sicht auf die einzelnen Gewebsschichten gewährleistet. Die weitere Torkarplatzierung erfolgt unter Kamerasicht und nach Lagerung in Anti-Trendelenburg-Position.
Drei weitere 12mm Trokare werden dann in folgender Reihenfolge platziert. Zunächst circa 1,5 handbreit unterhalb des Processus xiphoideus paramedian links (weit supraumbilikal), dann ungefähr in der Medioclavicularlinie unmittelbar am Rippenbogen rechts, dabei wird die Trokarspitze in Richtung linke untere Patientenextremität geführt. Der dritte 12mm Trokar wird schließlich circa eine Handbreit unterhalb des rechten Rippenbogens medial der Medioclavicularlinie im rechten Oberbauch eingebracht, zuletzt dann noch ein zusätzlicher 5mm Trokar am linken Rippenbogen etwas kranial des ersten 12mm Trokars.
Bemerkung: Ein Leberretraktor wird ausschließlich bei extrem großen Lebern verwendet, was in weniger als 5% der Patienten der Fall ist.