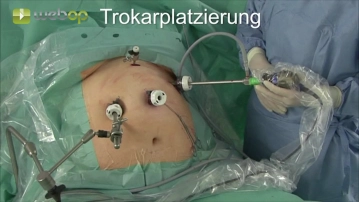
Die Position des Kameratrokars ist im linken Oberbauch. Auf eine Mindestentfernung zum Xyhoid von 15 cm sollte geachtet werden.
Zwei weitere 12 mm Trokare werden epigastrisch median und unterhalb des rechten Rippenboigens platziert. Ein 5 mm Trokar wird hochepigastrisch median eingebracht.