Oberbauch-Rechtwinkel-Laparotomie und Exploration des Abdomens zum Ausschluss eines extrahepatischen Tumors und einer Peritonealcarcinose (nicht dargestellt). Durchtrennung des Lig. falciforme bis auf die Ebene der Einmündung der Lebervenen in die Vena cava.
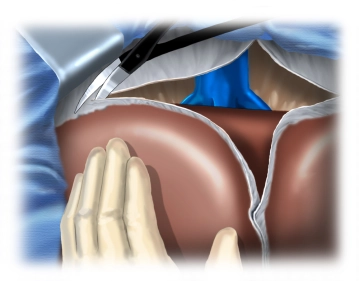
Lösen beider Leberlappen aus den Verwachsungen mit den Ligamenta triangularia mit Freilegung der retrohepatischen Vena cava inferior.
Die Vena cava inferior wird von kaudal nach kranial präpariert, wobei die kleineren distalen Lebervenen schrittweise freigelegt werden. Dabei werden in diesem Fall zunächst zwei größere,variabel auftretende, inferiore Venenäste zwischen Overholtklemmen abgesetzt und ligiert.
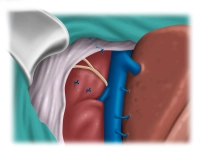
Die Versorgung der kurzen zentralen Lebervenen in die Vena cava inferior erfolgt je nach Kaliber mittels Clip oder Durchstechungsligatur.
Tipp: Eine großzügige retrohepatische Mobilisation erleichtert die Resektion und verhindert Blutverluste oder eine Verletzung der Vena cava bei der anterioren Traktion der Leber während der Parenchymdurchtrennung.