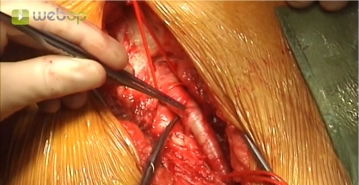
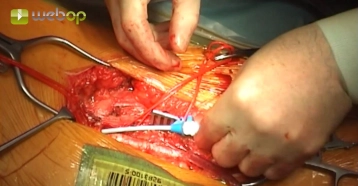
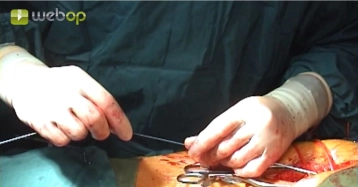
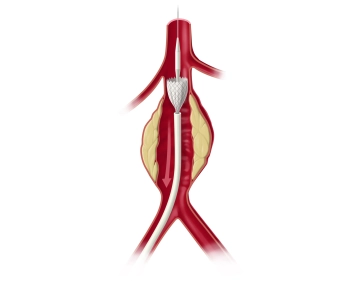
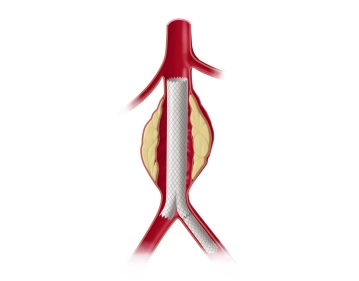
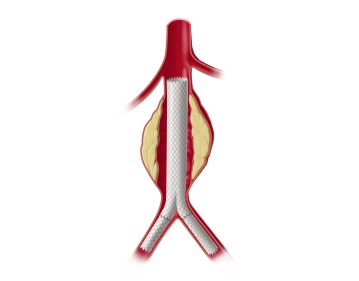
Die längsverlaufende Hautinzision erfolgt distal der Inguinalregion am proximalen Oberschenkel ca. 1 cm lateral der tastbaren Femoralarterie. Nach Durchtrennung der Subkutis wird die Oberschenkelfaszie medial des M. sartorius längs inzidiert. Am kaudalen Rand der Inzision wird die Faszie des Adduktorenkanals eröffnet, die A. femoralis superficialis dargestellt und mit einem Vessel Loop angeschlungen. Die unterhalb des Leistenbandes kreuzenden Lymphkollektoren werden zwischen Overholtklemmen durchtrennt und mit Stechungsligaturen versorgt. Anschlingen der A. femoralis communis und der A. profunda femoris.
Gleiches Manöver zur Freilegung der Femoralisgabel linke Leiste.
Tipps:
1. Der Zugang lateral der Femoralarterie schont die Lymphkollektoren und ermöglicht später einen Kulissenverschluss mit dem Ziel einer sicheren Wundheilung.
2. Die A. femoralis superficialis dient als Leitstruktur, um lateral daran nach proximal zu präparieren. Man findet auf diese Weise problemlos die A. profunda femoris und die A. femoralis communis und läuft außerdem nicht Gefahr, die medial verlaufenden Venen zu verletzen.
3. Die Durchstechungsligaturen der Lymphkollektoren helfen spätere Lymphzysten und Lymphfisteln weitestgehend zu vermeiden. Postoperative Lymphansammlungen in der Leiste bahnen nicht selten einen tiefen Wundinfekt mit fatalen Folgen.
4. A. circumflexa femoris: Sie liegt manchmal versteckt und kann zu starken Rückblutungen führen, wenn sie nicht ausgeklemmt wird.