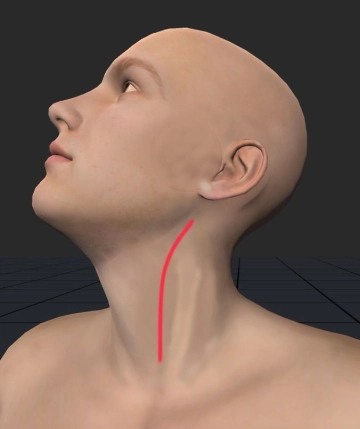
Längsschnitt am Vorderrand des Musculus sternocleidomastoideus links. Durchtrennung der Subkutis und des Platysmas, subtile Blutstillung.
-
Zugang links cervical
-
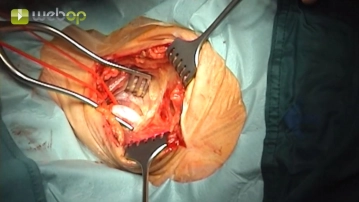
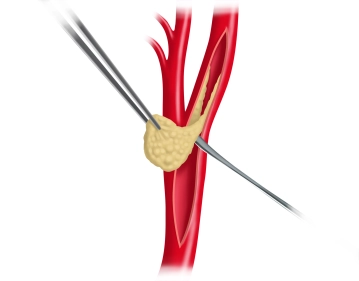
Präparation der ACC
![Präparation der ACC]()
Toneinstellungen Darstellung der Vorderseite der Arteria carotis communis (ACC), die dann umfahren und mit einem Vessel Loop als Tourniquet angeschlungen wird.
Tipp:
Goldene Regel für die Präparation: Wegen der Gefahr der Embolisation wird das umgebende Gewebe von der ACC abpräpariert, nicht umgekehrt. Dabei sollte das Gefäß so wenig wie möglich bewegt werden.
-
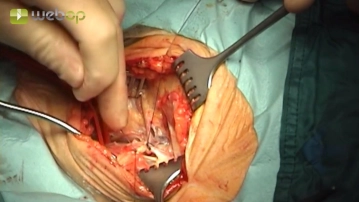
Absetzen der Vena facialis, partielle Durchtrennung des Musculus digastricus
![Absetzen der Vena facialis, partielle Durchtrennung des Musculus digastricus]()
Toneinstellungen Präparation der Vena facialis, die zwischen Durchstechungsligaturen durchtrennt wird. Durchtrennung der sehnigen Anteile am Vorderand des Musculus digastricus.
Tipp:
Die Vena facialis sollte nicht mit einfachen Ligaturen, sondern immer mit Durchstechungsligaturen versorgt werden. Bei der Narkoseausleitung oder auch beim Husten des Patienten entstehen hohe Drücke in den Halsvenen, die zum Abrutschen einfacher Ligaturen führen können, was intensive Blutungen zur Folge haben kann.
-
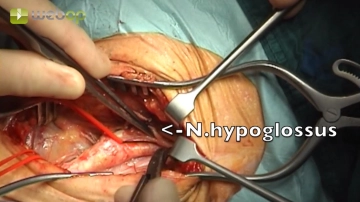
Präparation der ACE und ACI , Mobilisation des Nervus hypoglossus
![Präparation der ACE und ACI , Mobilisation des Nervus hypoglossus]()
Toneinstellungen Im kranialen Wundwinkel Einsetzen eines stumpfen Wundspreizers und Langenbeckhaken. Mobilisation des Nervus hypoglossus und der Ansa cervicalis. Präparation und Anzügeln der Arteria carotis externa (ACE). Antefixation des Nervus hypoglossus durch eine perineurale Annaht an die Unterkiefermuskulatur. Anschlingen der Arteria carotis interna (ACI).
Tipps:
1. Dieser OP-Schritt erfordert das Einsetzen von stumpfen Spreizern und Haken in den kranialen Wundwinkel. Dabei darf kein allzu großer Druck ausgeübt werden, da es ansonsten zur Schädigung des Mundastes des Nervus facialis kommen kann (herabhängender Mundwinkel postoperativ).
2. Präparation nur lateral der Ansa cervicalis. Wird medial präpariert, kann das die Vaskularisation des Nervus hypoglossus beeinträchtigen.
3. Stößt man bei der Präparation auf vergrößerte Lymphknoten, sollten diese en-bloc medialisiert werden.
4. Auch hier gilt: Perivaskuläres Gewebe von den Gefäßen abpräparieren, nicht umgekehrt.
5. Subtile Schonung des Nervus vagus! Für gewöhnlich liegt er „hinten“ zwischen Arteria carotis interna und Vena jugularis interna, gelegentlich aber auch weiter „vorne“ zwischen den Gefäßen. Bei arteriosklerotisch bedingten perivaskulären Verklebungen wie im Filmbeispiel muss der äußerst empfindliche Nerv vorsichtig von der Carotis gelöst werden, damit er später nicht zwischen die Branchen der Gefäßklemmen gerät. Auch sollte der Nervus vagus nicht mit in den Spreizer einbezogen werden.
6. Ist eine weit periphere (kraniale) Freilegung der Arteria carotis interna erforderlich, stößt man auf den Musculus digastricus und gelegentlich auch auf den Nervus glossopharyngeus (N. IX). Auch dieser Nerv muss sorgfältig geschont werden, da die Patienten ansonsten unter äußerst quälenden Koordinationsstörungen beim Schlucken leiden.
7. Auf ein Anschlingen des Nervus hypoglossus (N. XII) sollte möglichst verzichtet werden, da dies eine unnötige zirkuläre Präparation des Nerven erforderlich macht. Durch zu starke Devaskularisation und Hin- und Herbewegen des Nerven kann dieser Schaden nehmen (Folgen: kloßige Sprache, Patienten beißt sich beim Kauen ipsilateral auf die Zunge). Statt Anschlingen ist ein temporäres Hochnähen des Nerven an die Unterkiefermuskulatur möglich. Dazu wird nur das Perineurium gefasst und die Naht locker gelegt („Luftknoten“).
-
Ausklemmen der Carotisbifurkation und TEA
![Ausklemmen der Carotisbifurkation und TEA]()
Toneinstellungen Systemische Gabe von 5000 IE Heparin und Abwarten der Kreislaufzeit. Unter reiner Sauerstoff-Beatmung Ausklemmen der Carotisbifurkation: ACC mit einer 120°-Klemme, ACI mit einer weichen Gregory-Klemme und zuletzt die ACE mit einer gebogenen Klemme. Längsinzision der ACC in Richtung ACI über die periphere (= kraniale) Grenze der ACI-Stenose hinaus. Lokale TEA der Carotisbifurkation mittels Gefäßspatel, die nach peripher in die ACI hinein ohne Stufenbildung erfolgt. Zur Vorbereitung der folgenden Shunteinlage vorsichtiges Aufdehnen der ACI peripher mittels Klemme.
Tipps:
1. Die Arteria thyreoidea superior kann, sofern erforderlich, mit einer Bulldog-Klemme verschlossen werden.
2. Die ACI muss weit genug nach peripher (= kranial) präpariert werden. Ansonsten kann eine Dissketion eintreten, die - wenn überhaupt - nur schwer beherrschbar ist. Bei drohender Dissektion sind Intima-Fixationsnähte nach peripher von Nachteil, da es trotzdem zu weiterer Dissektion oder gar Embolisation kommen kann.
Nach sicherer TEA der ACI ohne Zurücklassen einer Intima-Stufe wird ein Shuntröhrchen (meist 5-F) i
Jetzt freischalten und direkt weiter lernen.
Einzelfreischaltung
Freischaltung dieses Lehrbeitrags für 3 Tage.
Beliebtestes Angebot
webop - Sparflex
Kombiniere flexibel unsere Lernmodule und spare bis zu 50%.
52,55 $/ jährliche Abrechnung
Gefäßchirurgie
Alle Lehrbeiträge in diesem Modul freischalten.
105,10 $ / jährliche Abrechnung
Webop fühlt sich der Lehre verpflichtet. Deswegen bieten wir alle unsere Inhalte auch zum fairen Studententarif an.