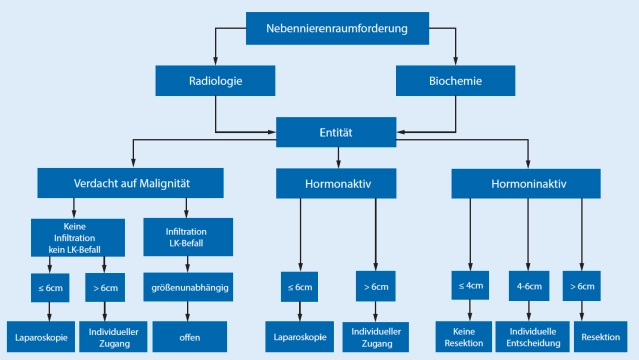
In den Leitlinien besteht Konsens, dass die meisten Nebennierentumoren bei gegebener Indikation minimal-invasiv operiert werden sollten. Tumordurchmesser >6 cm und deutliche Hinweise auf Malignität in der präoperativen Bildgebung gelten als Grenzen der minimal-invasiven Chirurgie.
Für die offene Adrenalektomie sollen der transabdominale bzw. der thorako-abdominale Zugang bevorzugt werden, da die Hauptindikation zum offenen Verfahren malignomverdächtige große Tumoren sind.
Bei suspekte Nebennierentumoren ab 6-8 cm Größe und Hounsfield-Einheiten (HU) (Dichtewerte der NN-RF) >20 ist ohne präoperativen Nachweis einer Malignität ein offener Zugang (+Lymphadenektomie) zu bevorzugen.
Eine R0-en-bloc-Resektion mit umgebendem retroperitonealem Fettgewebe sollte angestrebt, eine Tumorkapseleröffnung vermieden werden, zumindest bildmorphologisch auffällige LK sollten simultan mitentfernt werden.
- Endokrin-aktive Tumoren der Nebennierenrinde (Conn- oder Cushing-Adenome, Tumoren mit Androgensekretion) > 10 cm
- Conn-Syndrom (primärer Hyperaldosteronismus, PHA):
Die häufigste Ursache einer sekundären Hypertonie ist der primäre Hyperaldosteronismus.
Bei einem unilateralen aldosteronproduzierenden Adenom ist die unilaterale Adrenalektomie indiziert.
Bei Patienten mit PHA und beidseitigen Nebennierenveränderungen kann eine Operation erwogen werden, wenn das adrenale Venensampling (AVS durch selektiven Nebennierenvenenblutentnahme) eine funktionelle Lokalisation zeigt.
- Cushing-Syndrom (Hyperkortisolismus)
Ein florides adrenales Cushing-Syndrom mit klassischen klinischen Stigmata stellt eine OP-Indikation dar.
Vor einer möglichen operativen Entfernung des NN-Tumors muss die ACTH-Unabhängigkeit des Kortisolexzesses bestätigt werden, damit der Eingriff nicht fälschlicherweise erfolgt, obwohl die Ursache des Hormonexzesses beispielsweise hypophysär bedingt ist.
Ausschluss ACTH-abhängiger Hyperkortisolismus (Adenom des Hypophysenvorderlappens) (zentrales Cushing-Syndrom) oder paraneoplastisches Syndrom mit ektoper ACTH-Sekretion bei Tumorerkrankung.
- Sexualhormon produzierende Nebennierenrindentumoren
Ein adrenokortikales Karzinom ist die häufigste Ursache für eine klinisch relevante pathologische Androgen-/Östrogensekretion aus der Nebenniere, Adenome sind sehr selten.
- Conn-Syndrom (primärer Hyperaldosteronismus, PHA):
- Nebennierenrindenkarzinom Adrenokortikales Karzinom (ACC) ENSAT-Stadium I-III Link zu ENSAT-Klassifikation
- Bei der Erstdiagnose fast immer > 4cm und weist in 50-80% eine endokrine Aktivität auf. Typisch ist eine Cortisolproduktion oder eine gemischt-hormonelle Produktion (Androgene/Östrogene und Cortisol).
- Beim Nebennierenrindenkarzinom ist die offene Adrenalektomie der Goldstandard. Bei Tumoren < 6 cm ohne Hinweis auf lokale oder Lymphknoteninfiltration (ENSAT Std. I+II) kann eine minimal-invasive Adrenalektomie erfolgen.
- Eine radikale Tumorresektion mit Entfernung der Nebenniere und des gesamten Fett-/Bindegewebes im betroffenen Kompartiment ohne Kapseleröffnung und eine Lymphadenektomie, diese bei unsicherer Datenlage, wird empfohlen. Eine Definition hinsichtlich der Ausdehnung der erforderlichen Lymphadenektomie liegt bisher nicht vor.
- Bemerkung: Die Rate an lokalen und peritonealen Rezidiven ist in der laparoskopischen Gruppe laut aktueller Evidenz erhöht. Eine Konversion von laparoskopischer zu offener Adrenalektomie verschlechtert das Gesamtüberleben.
- Phäochromozytom (PC) Nebennierenmarktumor mit Katecholaminexzess bei Verdacht auf Malignität, sehr großen Tumoren oder wenn technische Schwierigkeiten zu erwarten sind.
- Ca 1/3 aller Phäochromozytom-Patienten sind einem hereditären Tumorsyndrom zuzuordnen. Das genetische Screening ist unverzichtbarer Bestandteil der Phäochromozytom Diagnostik. SDHB-assoziierten Tumoren sind mit einem besonders hohen Malignitäts- und Rezidivrisiko behaftet.
- Insgesamt sind 10 % der PC maligne. Beweisend für ein malignes Phäochromozytom sind ausschließlich Metastasen.
- Myelolipome stellen per se keine Operationsindikation dar.
Große adrenale Myelolipome (hormoninaktive gutartige Tumore, die reifes Fettgewebe und hämatopoetisches Gewebe enthalten) können durch Nekrose oder spontane Einblutung symptomatisch werden. In diesen Fällen kann eine Resektion erforderlich werden.
- Nebennierenmetastasen (von malignen Tumoren anderen Ursprungs) sollten entfernt werden, wenn keine weiteren Metastasen vorliegen und durch die Entfernung Tumorfreiheit erreicht wird.
Bemerkung: Die Metastasen-Adrenalektomie sollte minimal-invasiv vorgenommen werden, sofern die Metastase in toto und ohne Tumorzellaussaat entfernt werden kann. Ein offenes Vorgehen bleibt den wenigen Fällen vorbehalten, bei denen es Hinweise für eine lokale Infiltration gibt oder wenn die Metastase 6 cm überschreitet.
- Große Schwannome oder adulte Neuroblastome
- Pulmonale oder kardiale Probleme, die einen minimal-invasiven Eingriff ausschließen.
- Vorliegen von intraabdominellen oder retroperitonealen Verwachsungen nach Voroperationen