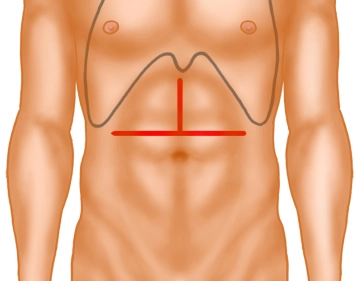
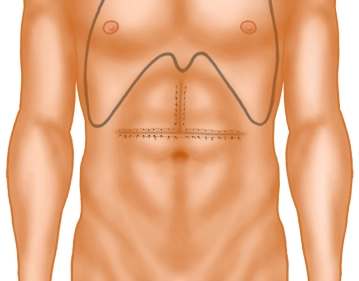
Die Eröffnung des Abdomens erfolgt über eine Oberbauchquerlaparotomie mit oberer Medianlaparotomie, sogenanntes “umgekehrtes T“.
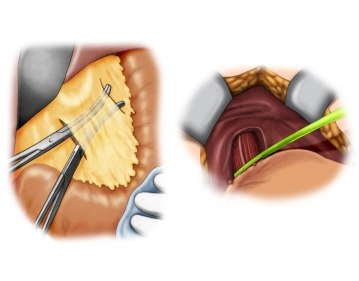
Dann wird mittels Diathermie das Subkutangewebe und anschließend die Rektusmuskulatur auf der Holzrinne durchtrennt.
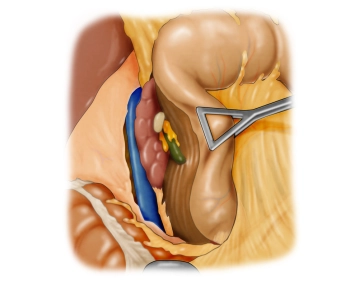
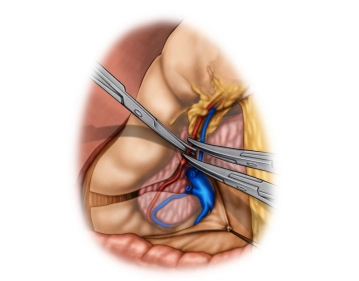
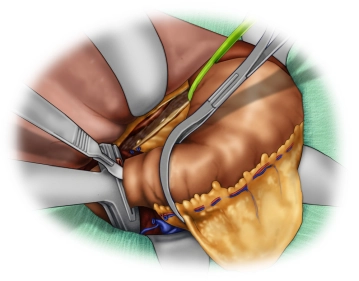
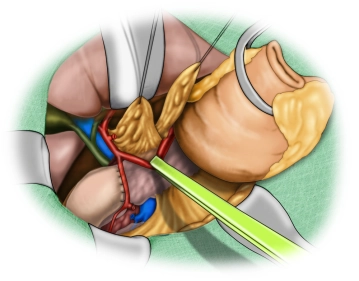
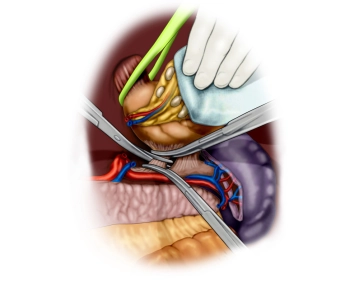
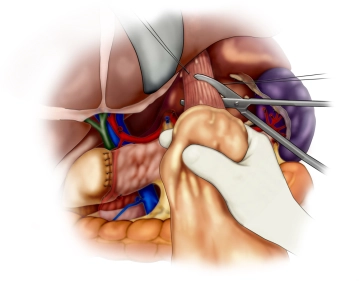
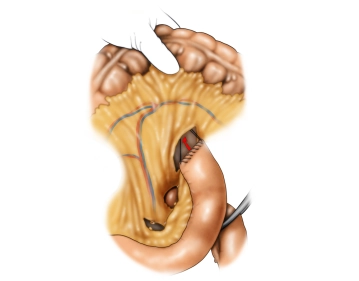
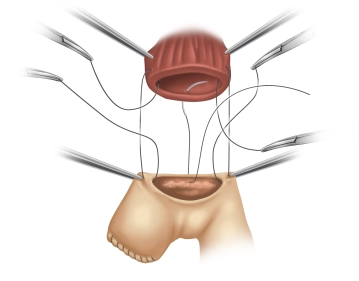
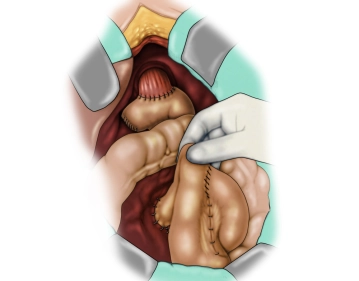
Die eröffnete Bauchhöhle wird nun exploriert, um Lage und Ausdehnung des Tumors und somit die Resektabilität nach Ausschluß von Fernmetastasen, insbesondere an Peritoneum und Leber, beurteilen zu können. Der Tumor ist im mittleren Drittel des Magens an der großen Kurvatur gelegen.
Aktive lokale Hämostase und Versiegelung
TachoSil® Versiegelungsmatrix
TachoSil® wird bei Erwachsenen und Kindern ab einem Alter von 1 Monat zur unterstützenden Behandlung in der Chirurgie zur Verbesserung der Hämostase, zur Unterstützung der Gewebeversiegelung und zur Nahtsicherung in der Gefäßchirurgie angewendet, wenn Standardtechniken insuffizient sind. TachoSil® wird bei Erwachsenen zur unterstützenden Versiegelung der Dura mater angewendet, um postoperative Liquorleckagen nach neurochirurgischen Eingriffen zu vermeiden.
Produktwebsite TachoSil®
TachoSil® Fachinformation 05-2025 (354,1 kB)