Carcinoma Gástrico Primário
Em uma abordagem terapêutica curativa e resecabilidade local, há geralmente uma indicação para cirurgia, desde que não haja fatores de risco significativos (por exemplo, condições pré-existentes ou a condição geral do paciente; veja também contraindicações).
Para tumores localmente avançados dos estágios II e III (cT1/cT2N+ e cT3/cT4Nx ressecável), quimioterapia pré ou perioperatória deve ser realizada.
Para alcançar margens de ressecção livres de tumor (R0), uma margem de segurança proximal de 5 cm (para o tipo intestinal de acordo com Lauren) ou 8 cm (para o tipo difuso de acordo com Lauren) é geralmente necessária, exceto para carcinomas mucosos (T1a N0 M0). A extensão da ressecção (gastrectomia total versus subtotal) é determinada pela localização e disseminação do tumor, bem como pelo tipo histológico, que requer uma margem de segurança apropriada.
Carcinoma Gástrico Precoce
Um carcinoma gástrico precoce é definido como um tumor que, independentemente do status dos linfonodos, área de superfície e metástases distantes, está confinado à mucosa e submucosa da parede do estômago. A muscularis própria do estômago está livre de tumor por definição.
Em carcinomas precoces, a frequência de metástase linfonodal varia. Tumores que já infiltraram a submucosa não são elegíveis para terapia endoscópica, pois há uma probabilidade de 4-20% de metástase linfonodal.
Cerca de 5% dos pacientes apresentam um carcinoma gástrico precoce do tipo mucoso (pT1m), onde a terapia curativa por ressecção endoscópica é possível, pois a probabilidade de metástase linfonodal é extremamente baixa. Os pacientes afetados têm um excelente prognóstico com uma taxa de sobrevivência de cinco anos superior a 90%.
Indicações para Ressecção Endoscópica
Carcinomas gástricos superficiais confinados à mucosa (cerca de 5% dos pacientes) podem ser tratados com ressecção endoscópica considerando os seguintes critérios:
- Lesions < 2 cm in size for elevated types
- Lesions up to 1 cm in size for flat types
- Histological differentiation grade: well or moderately (G1/G2)
- No macroscopic ulceration
- Invasion confined to the mucosa
Situações Especiais:
Carcinoma de Coto Gástrico (Tumores Recorrentes após Gastrectomia Subtotal):
Gastrectomia complementar resultando em gastrectomia total.
Oligometástases:
Como parte de uma abordagem multimodal, dentro de estudos e quando tecnicamente viável, todos os sítios metastáticos podem ser removidos. Metástases descobertas intraoperatoriamente podem, similar à diretriz esofágica, ser ressecadas se forem R0-ressecáveis.
Metástases Peritoneais:
Requisitos:
- PCI < 12
- Ressecção completa de todas as partes tumorais macroscopicamente visíveis possível
Procedimento:
- Terapia sistêmica neoadjuvante
- Ressecção oncológica (gastrectomia/ressecção gástrica subtotal) com linfadenectomia D2 e margens de ressecção livres de tumor
- Ressecção completa de metástases peritoneais (cirurgia citorredutora)
- Quimioterapia intraperitoneal hipertérmica
Em uma abordagem terapêutica paliativa, a gastrectomia pode ser indicada em casos raros (por exemplo, em sangramento, perfuração, estenose).
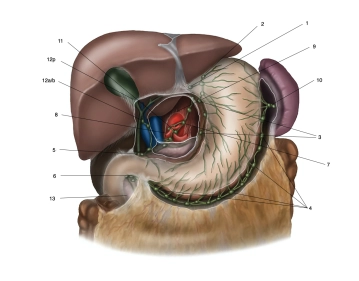
Linfadenectomia
A dissecção de linfonodos dos compartimentos I e II é referida como D2-LAD e representa a linfadenectomia padrão para carcinoma gástrico. É considerada o padrão ouro.
Baseado na classificação japonesa (numeração), os linfonodos são agrupados em vários compartimentos. Os linfonodos D1 incluem estações 1 a 6, o compartimento D2 inclui adicionalmente estações 7 a 11.
Os linfonodos da estação 12 são ressecados no contexto da ressecção oncológica para carcinomas localizados distalmente no lado da curvatura menor. Linfonodos no ducto biliar principal (estação 12b, considerada M1) frequentemente não são ressecados para evitar lesão/desvitalização do ducto biliar.
No compartimento D3, grupos 12 a 15 estão localizados, que por definição não são estações de linfonodos regionais do estômago. Como são prognosticamente considerados metástases distantes, são classificados como M1 LYM se envolvidos.
Para alcançar uma classificação de pN0, a UICC requer um mínimo de 16 linfonodos regionais a serem examinados. A diretriz alemã S3 especifica uma contagem intencionada de linfonodos de ≥ 25.