Anamnese
- lokale Symptome einer Schilddrüsenvergrößerung, Knotenwachstum (zervikales Druck- oder Globusgefühl, Schluckbeschwerden und Dyspnoe, insb. unter Belastung)
- Stimmveränderungen/Heiserkeit, Rekurrensparese
- Symptome einer Hyperthyreose
- Medikamente (jodhaltige Präparate, Thyreostatika)
- Familienanamnese
- frühere Bestrahlungen im Halsbereich: Gesicherter ätiologischer Faktor für die Entstehung eines differenzierten Schilddrüsenkarzinoms ist die Einwirkung ionisierender Strahlen, weshalb Patienten mit Schilddrüsenknoten gezielt nach früheren Bestrahlungen der Kopf-Hals-Region zu befragen sind.
- Vorbestehende HWS-Probleme (Kopfreklination bei Lagerung!)
körperliche Untersuchung
- Palpation (Größe, Konsistenz der Schilddrüsenlappen, Knoten, Schluckverschieblichkeit, tastbare Lymphknoten)
- endokrine Ophthalmopathie
Stimmbandfunktionsprüfung
- Eine präoperative HNO-ärztliche Laryngoskopie zur Beurteilung der Stimmlippenbeweglichkeit ist unerlässlich.
- Sie kann eine bereits präoperativ vorliegende Schädigung des N. recurrens, z. B. nach Voreingriff oder bei Malignität erfassen.
- Sie ermöglicht eine situationsangepasste Operationstaktik.
- Sie ist Grundlage der perioperativen Qualitätssicherung
- Prä- und postoperative Laryngoskopie und das intraoperative Neuromonitoring stellen die Grundlage der perioperativen Qualitätssicherung dar und sind eine untrennbare diagnostische Einheit. Das Neuromonitoring ist ohne Kenntnis der klinischen Larynxfunktion nicht verwertbar! LINK IONM
Laboruntersuchungen
- üblichen präoperativen Laborparameter je nach Grunderkrankung, Gerinnung, Calcium, PTH
- TSH, Schilddrüsenhormone: fT3, fT4
Wichtigster in-vitro-Parameter ist das TSH, dessen pathologische Veränderung auf einer länger bestehende Funktionsstörung der Schilddrüse beruht. Hinweis: Bei erniedrigter Konzentration besteht der Verdacht auf eine Hyperthyreose, bei erhöhter Konzentration auf eine Hypothyreose. In diesen Fällen ist eine zusätzliche Bestimmung der Schilddrüsenhormone (fT3 und fT4) zwingend erforderlich, bei normwertigem TSH und klinischer Euthyreose kann darauf verzichtet werden.
- Schilddrüsenantikörper zur Diagnostik von Immunthyreopathie und Thyreoiditis
- Antikörper gegen TSH-Rezeptor (TRAK) sollten bestimmt werden, wenn aufgrund der klinischen Untersuchung und der bildgebenden Verfahren keine eindeutige Abgrenzung zwischen einem M. Basedow und einer nichtimmunogenen Hyperthyreose möglich ist.
- Antikörper gegen Schilddrüsenperoxidase (anti-TPO) werden bei Verdacht auf eine Autoimmunerkrankung der Schilddrüse bestimmt; sie sind bei 95 % der Patienten mit Hashimotothyreoiditis (Autoimmunthyreoiditis) und bei 70 % der Patienten mit M. Basedow erhöht.
- Antikörper gegen Thyreoglobulin (anti-TG) sind unspezifischer, werden ergänzend bei Verdacht auf eine Autoimmunthyreoiditis bestimmt, besonders wenn Anti-TPO negativ ist.
- Bestimmung des basalen Calcitoninwerts.
Calcitonin (Ctn) ist ein hochspezifischer Tumormarker für das medulläre Schilddrüsenkarzinom (MTC). Die deutschsprachigen Leitlinien empfehlen vor jeder Schilddrüsenoperation die einmalige Bestimmung, um C-Zell-Veränderungen bereits in früher Form zu entdecken. Die Höhe des basalen Calcitoninwerts lässt Rückschlüsse auf das Stadium der Erkrankung zu und hilft das Resektionsausmaß zu planen.
Ab einem Grenzwert von ≥ 30 pg/ml Ctn für Frauen und von ≥ 60 pg/ml für Männer liegt mit ausreichend hoher Wahrscheinlichkeit ein MTC vor, um weitere Behandlungsschritte zu rechtfertigen.
LK-Metastasen im lateralen Lymphknotenkompartiment scheinen erst ab einem Calcitoninwert über 85/100 pg/ml und gleichzeitigem Nachweis von Desmoplasie aufzutreten. Ansonsten kann auf eine laterale LK-Dissektion verzichtet werden. 25% der Tumoren sind familiär, z.B. Leittumor bei MEN 2a. Deshalb empfiehlt sich bei V.a. MTC immer eine molekulargenetische Abklärung.
- Bemerkung: Rauchen, Protonenpumpeninhibitoren, eine Niereninsuffizienz und chronischer Alkoholkonsum können zu leicht bis mäßig erhöhten Calcitonin-Werten führen (gegebenenfalls Kontrolle unter Abstinenz).
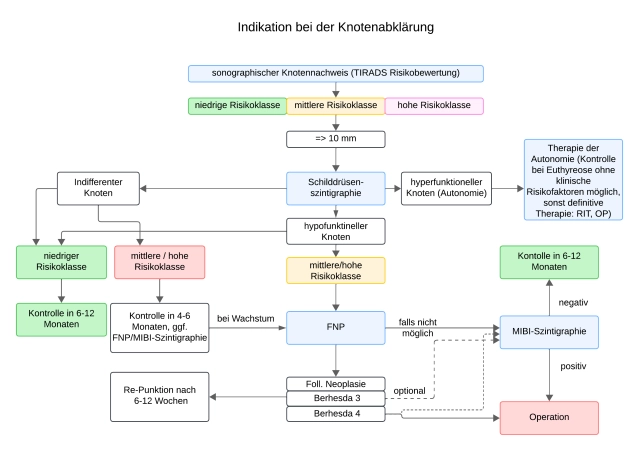
Sonographie mit TI-RADS-Einteilung (Thyroid Imaging Reporting and Data System)
Der präoperative Halssonographie kommt in der OP-Planung eine große Bedeutung zu. Sie stellt die Basisuntersuchungsmethode zur Beurteilung der Schilddrüsen-Morphologie dar.
Durch die Standardisierung der Befundung der Schilddrüsenknoten erfolgt eine Dignitätsbeurteilung bzw. Risikostratifizierung des Knotens, die von den Leitlinien auch so gefordert wird.
Knotige Befunde der Schilddrüse werden im Detail beschrieben unter Dokumentation folgender Kriterien:
- Größe (Durchmesser in allen 3 Ebenen angeben)
- Echogenität (echoarm, echonormal, echoreich, echofrei und echokomplex)
- zystische Anteile
- Mikro- oder Makroverkalkungen
- Vorhandensein eines echoarmen Randsaums (Halo-Zeichen)
- Randbegrenzung (scharf versus unscharf)
- Konfiguration (asymmetrisch, „höher als breit“)
- Vaskularisation
Folgende sonographische Kriterien sind mit einer deutlich erhöhten Wahrscheinlichkeit für Malignität assoziiert:
- Echoarmut
- unscharfe Begrenzung
- nichtovale Form
- „Taller-than-wide"-Form: Knoten ist im axialen Schnittbild mehr in der Tiefe als in der Breite ausgeprägt.
- Vorhandensein von Mikrokalk
LINK TIRADS
Bemerkung:
Durch die Sonographie kann auch die Beziehung zu Nachbarstrukturen, der Lymphknotenstatus und evtl. eine retrosternale Ausbreitung eingeschätzt werden.
Szintigraphie der Schilddrüse
Die Szintigraphie mit dem Tracer 99m-Technetiumpertechnetat (Tc-99m) weist eine Diskriminierungsgrenze von etwa 1cm für Läsionen auf, die entweder mehr, gleich oder minderspeichernd zum umgebenden Gewebe sind und damit als szintigraphisch warm/heiß (bei gleichzeitiger Supprimierung des umgebenden Gewebes), indifferent oder kalt beschrieben werden.
Bemerkungen:
- Das Szintigramm ist zusammen mit der Sonographie Basisuntersuchungsmethode in der Abklärung von Schilddrüsenknoten.
- Autonome Areale, die nicht mehr der regulierenden Steuerung durch TSH unterliegen, können durch eine Suppressions-Szintigraphie (mit oral zugeführtem Thyroxin) demaskiert werden.
- Auch bei einem TSH-Wert im Normbereich können funktionell autonome Knoten vorliegen. Diese sollten nicht punktiert werden.
- Szintigraphisch nachgewiesene kalte Knoten, die sonographisch echoleer sind, entsprechen Zysten und sind als benigne einzustufen.
- Nicht echoleere kalte Knoten sind abklärungsbedürftig
Fakultative präoperative Diagnostik
Magnetresonanztomographie/Nativ-Computertomographie
- Bei retrosternaler Struma, um das Ausmaß des retrosternalen Anteils einschätzen zu können, wodurch die präoperative Planung eines eventuell notwendigen thoraxchirurgischen Zugangsweges (Sternotomie) erleichtert wird.
- bei ausgeprägten lokalen Kompressionserscheinungen
- bei organüberschreitendem Wachstum
Bemerkung 1: Bei der Ersteinschätzung von Schilddrüsenknoten haben diese beiden Untersuchungen keinen Stellenwert.
Bemerkung 2: Beim differenzierten Schilddrüsenkarzinom (DTC) sollte eine MRT bevorzugt durchgeführt werden, um eine Kontrastmittelexposition zu vermeiden.
Die Computertomographie hat den Nachteil, dass grundsätzlich auf die Kontrastierung mit Kontrastmittel verzichtet werden muss, einerseits wegen der Gefahr der jodinduzierten Hyperthyreose, andererseits, um eine Jodkontamination im Hinblick auf eine Radiojodtherapie zu vermeiden. Nach exogener Jodzufuhr sind die Jodrezeptoren über einen längeren Zeitraum blockiert, was eine Radiojodtherapie und eine Schilddrüsenszintigraphie unmöglich macht.
PET-CT
- Molekulare Ganzkörperbildgebung bei fortgeschrittenen Tumoren zur Rezidiv- und Metastasendiagnostik mit funktionellen Tracern wie Dopamin (18F-DOPA), Somatostationanaloga (68Ga-DOTATOC) beim MTC und FluorDesoxyGlucose (18F-FDG) beim PDTC (Poorly Differentiated Thyroid Carcinoma), das häufig kein Radiojod speichert.
Szintigraphie mit ⁹⁹ᵐTc-MIBI mit Washout-Index als semiquantitatives Verfahren
Für die Beurteilung der Dignität von Schilddrüsenknoten wird die Sestamibi-Szintigraphie klinisch off-label eingesetzt. Über den Off-Label-Use muss aufgeklärt werden. Die MIBI-Szintigraphie soll nur bei szintigraphisch hypofunktionellen Knoten ab 1 cm Größe und suspekter Sonomorphologie (TIRADS 4und 5) und Nachweis einer follikulären Neoplasie (Bethesda 3/4) eingesetzt werden.
Die Bildgebung mit ⁹⁹ᵐTc-MIBI kann insbesondere dann eingesetzt werden, wenn eine Feinnadelpunktion indiziert, aber nicht möglich oder ohne aussagekräftigen Befund geblieben ist.
Der prädiktive negative Vorhersagewert bei schnellem Washout ist gut, Verlaufskontrollen sind erforderlich.
Punktionszytologie/Feinnadelpunktion
Auf der Basis von klinischen, sonographischen und szintigraphischen Kriterien werden Risikoknoten identifiziert, die dann durch die Feinnadelpunktion weiter abgeklärt werden. Weil in Deutschland häufig multinodöse Schilddrüsenveränderungen vorkommen, empfiehlt es sich, die Punktionsnotwendigkeit auf nichtautonome Knotenareale >1 cm – in Abhängigkeit von sonographischen Merkmalen – einzugrenzen.
Die Feinnadelpunktion (FNP) eines suspekten Schilddrüsenknotens dient der Abschätzung des Malignitätsrisikos. Sie ist insbesondere dann indiziert, wenn eine nicht-operative Therapie der Läsion erwogen wird.
Bei folgenden Konstellationen kann sich eine Indikation zur Punktion von Schilddrüsenknoten ergeben:
- Patienten mit klinischen Zeichen eines Schilddrüsenkarzinoms, wenn die zytologische Diagnose für die Operationsplanung von Bedeutung ist.
- Knoten je nach Größe ab EU-TIRADS-Einstufung Klasse 3: Klasse 3 (> 2 cm), Klasse 4 (> 1,5 cm), Klasse 5 (> 1 cm)
- Knoten jeder Größe mit extrakapsulärem Wachstum oder unklaren zervikalen Lymphknoten (hier sollte ggf. auch der Lymphknoten punktiert werden)
- Knoten jeder Größe bei Patienten mit einer Bestrahlung im Halsbereich in der Vorgeschichte ohne Nachweis einer Autonomie
- Verwandter ersten Grades bei einem Patienten mit papillärem bzw. medullärem Schilddrüsenkarzinom oder multipler endokriner Neoplasie Typ 2
Bemerkung: Beim MTC ist die Ctn-Bestimmung der Zytologie überlegen. Aufgrund des besonderen Stellenwertes des Calcitonin Screenings ist eine FNP für die präoperative Diagnose eines MTC in der Regel nicht erforderlich. Die Beurteilung einer desmoplastischen Stromareaktion in der Histologie ist nach einer FNP nicht mehr sicher möglich, deshalb sollte bei einem erhöhten Ctn keine FNP durchgeführt werden.
Ausdrücklich von einer Punktion absehen sollte man bei Knoten, die szintigraphisch fokalen Autonomien entsprechen, sowie bei Knoten, die keinerlei malignitätsverdächtige Sonographiekriterien aufweisen.
Zytologisch können viele Tumorentitäten mit hoher Genauigkeit diagnostiziert werden. Die follikuläre Neoplasie bedarf einer histologischen Abklärung.
Die Indikation zur Operation ist auf Grundlage der Zytologie gegeben bei follikulärer Neoplasie, Nachweis spezifischer Mutationen oder sonstigem Malignitätshinweis bzw. -nachweis.
Bei Nachweis von gutartigen Befunden in der FNP können unnötige Operationen vermieden werden. Bei Nachweis maligner Zellen wird die Operationsstrategie durch das Ergebnis der FNP wesentlich beeinflusst (Hemi- versus Thyreoidektomie, Ausmaß der Lymphknotendissektion).
Bei gekapselten follikulären Tumoren ist eine Unterscheidung zwischen follikulärem Adenom und Karzinom mittels FNP nicht möglich. Ebenso wenig kann durch die FNP zwischen einer nicht-invasiven gekapselten follikuläre Variante eines papillären Schilddrüsentumors (NIFTP) und einem papillären Schilddrüsenkarzinom unterschieden werden. Molekularpathologische Zusatzuntersuchungen können die Sensitivität und Spezifität der FNP erhöhen, werden aber noch nicht routinemäßig eingesetzt.
Das mit über 80 % aller differenzierten Schilddrüsenkarzinome am häufigsten auftretende papilläre Karzinom lässt sich mit hoher Zuverlässigkeit diagnostizieren.
Zytopathologische Auswertung der FNP
Die Bethesda-Klassifikation ist ein 6-gradiges System, das ausschließlich für die Schilddrüsenpunktion entworfen wurde und weitgehend evidenzbasiert ist. Der Vorteil in diesem System liegt in der klaren Zuordnung der Malignitätswahrscheinlichkeit in den einzelnen Gruppen. Darüber hinaus erlaubt diese Klassifikation aufgrund ihrer internationalen Verwendung eine internationale Vergleichbarkeit.
LINK Bethesda Klassifikation
Bei V.a. transmurale Infiltration zusätzlich Panendoskopie, Tracheoskopie und Ösophagoskopie