O câncer de pâncreas é a quarta principal causa de morte por câncer na Europa e espera-se que ocupe o segundo lugar em mortalidade por câncer até 2030 [1]. A única opção de tratamento potencialmente curativo é a ressecção cirúrgica, que ainda atinge uma taxa de sobrevivência de 5 anos de apenas 10% [2]. A biologia tumoral agressiva levou à introdução de novos regimes de quimioterapia mais eficazes, tanto adjuvantes quanto neoadjuvantes, nos últimos 10 anos, resultando no estabelecimento de conceitos de terapia multimodal.
Indicação para Cirurgia
Por iniciativa da Sociedade Alemã de Cirurgia Geral e Visceral (DGAV), foram definidas recomendações baseadas em evidências para a indicação de cirurgia de câncer de pâncreas, com a indicação a ser feita por um comitê de tumores de cirurgiões pancreáticos experientes de acordo com as diretrizes, levando em consideração as características individuais do paciente [3]. De acordo com as recomendações, com base na análise sistemática de 58 artigos originais e 10 diretrizes, há indicação para cirurgia em câncer de pâncreas histologicamente confirmado, bem como em uma alta suspeita de câncer de pâncreas ressecável [3, 4].
Ressecabilidade
A maior chance de sobrevivência é com a ressecção em tecido saudável, a ressecção R0 [5, 6]. As diretrizes atuais agora dividem a classificação R0 em "R0 estreito" (≤ 1 mm) e "R0 amplo" (> 1 mm), dependendo se o carcinoma atinge menos ou mais de um milímetro até a margem de ressecção [7]. Além da ressecabilidade anatômica (relação entre o tumor e os principais vasos viscerais), a biologia tumoral e a condição geral do paciente têm sido consideradas como critérios co-determinantes de ressecabilidade desde 2017 e foram incluídas nas diretrizes S3 atuais como a classificação de consenso ABC de ressecabilidade [8].
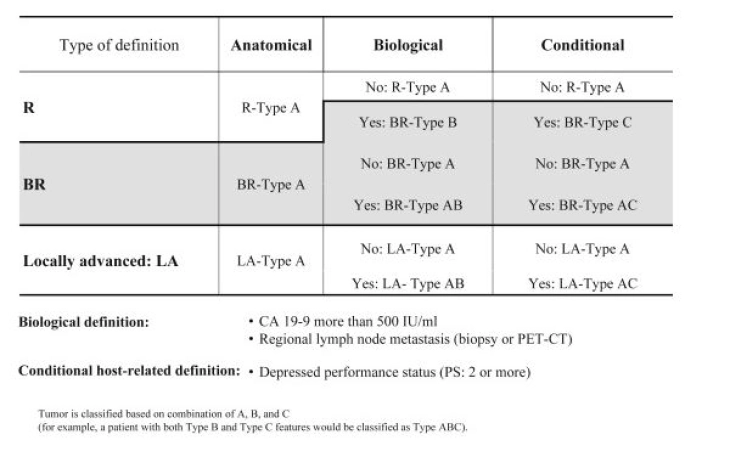
Critérios ABC de Ressecabilidade de Acordo com o Consenso da Associação Internacional de Pancreatologia (IAP)
(Clique para ampliar)
Fonte: Isaji S et al (2018) International consensus on definition and criteria of borderline resectable pancreatic ductal adenocarcinoma 2017. Pancreatology18(1):2–11.
Para avaliar a ressecabilidade anatômica, as diretrizes S3 recomendam uma tomografia computadorizada com contraste em 2 fases [7]. Com base nos critérios de ressecabilidade anatômica, um tumor pode ser classificado como primariamente ressecável, borderline ressecável e não ressecável ou localmente avançado [7].
A avaliação da ressecabilidade biológica é mais frequentemente baseada no marcador tumoral CA 19-9. O limiar foi definido como > 500 IU/ml, pois acima desse valor, a ressecabilidade é dada em menos de 70% dos casos e espera-se uma sobrevivência de menos de 20 meses [8, 9].
Outro critério é o ECOG Performance Status como ressecabilidade condicional, com pacientes tendo um status ≥ 2 apresentando um prognóstico ruim [8].
Mesopâncreas
O mesopâncreas, a região de tecido conjuntivo ao redor dos principais vasos da região pancreática, que é densamente atravessada por vasos sanguíneos e linfáticos, bem como por plexos nervosos, tem sido discutido há vários anos [10]. Meta-análises sugerem que a ressecção total do mesopâncreas permite melhores resultados oncológicos [11]. Na ressecção da cabeça do pâncreas, a remoção completa do tecido mesopâncreas entre a veia porta, artéria hepática, base do tronco celíaco e artéria mesentérica superior (Operação Triângulo [12, 13]) é realizada, enquanto nas ressecções pancreáticas esquerdas (carcinomas do corpo e cauda), a pancreatosplenectomia modular antegrada radical (RAMPS [14]) é realizada.
[RAMPS: Dependendo da extensão do tumor, distingue-se um procedimento RAMPS anterior de um posterior, no qual essencialmente uma ressecção mais radical é realizada dorsalmente. No RAMPS anterior, a ressecção é realizada com remoção da fáscia de Gerota e gordura perirrenal no lado esquerdo. Em contraste, no RAMPS posterior, além da fáscia de Gerota e gordura perirrenal, a glândula adrenal esquerda também é ressecada.]
Ressecção Vascular
Em centros, as ressecções venosas apresentam morbidade e mortalidade minimamente aumentadas, e uma sobrevivência geral adequada é possibilitada [15, 16]. De acordo com as diretrizes S3 atuais, a ressecção vascular da veia porta pode ser realizada em casos de infiltração tumoral ≤ 180° ou em situações complexas, como transformação cavernosa com reconstrução [17]. As ressecções arteriais, por outro lado, são muito arriscadas, frequentemente complexas e frequentemente requerem reconstruções venosas simultâneas. Os pacientes frequentemente não se beneficiam oncologicamente de procedimentos extensos e frequentemente mostram dados de sobrevivência piores do que pacientes sem ressecção vascular [18]. Portanto, as ressecções arteriais devem ser evitadas fora de centros.
Ressecções arteriais inesperadas podem ser evitadas por exposição precoce para verificar o status livre de tumor da artéria mesentérica superior e do tronco celíaco durante uma ressecção pancreática com intenção curativa. A estratégia "Artéria-primeiro" ajuda a evitar procedimentos fúteis, permite um melhor planejamento de ressecções e reconstruções vasculares e melhora a sobrevivência a longo prazo para pacientes selecionados em centros com expertise apropriada [19].
Oligometástase
O termo oligometástase aparece pela primeira vez nas diretrizes S3 atuais e descreve a presença de ≤ 3 metástases, que devem ser ressecadas apenas dentro de estudos como parte de um conceito de tratamento multimodal [7]. Ainda não há estudos randomizados disponíveis, mas a ressecção de oligometástases parece melhorar os dados de sobrevivência do paciente em comparação com a quimioterapia paliativa, especialmente após terapia neoadjuvante [20 - 23]. Na Alemanha, os estudos HOLIPANC e METAPANC estão atualmente abordando a questão [24].
Conceitos de Terapia Neoadjuvante
Para pacientes com câncer de pâncreas borderline ressecável, a diretriz atual recomenda quimioterapia ou quimiorradioterapia pré-operatória, enquanto para carcinomas ressecáveis, não deve ser realizada fora de estudos [7]. As recomendações são baseadas em dados de uma meta-análise e dados de estudos publicados atualmente [25, 26]. Como após a terapia neoadjuvante, a ressecabilidade em cânceres de pâncreas inicialmente borderline ressecáveis e localmente avançados é difícil de avaliar morfologicamente, a diretriz recomenda exploração cirúrgica para avaliar a ressecabilidade secundária em doença estável [7, 27]. Uma diminuição nos níveis de CA 19-9 também pode ajudar na avaliação da ressecabilidade secundária [28, 29].
Técnicas Laparoscópicas e Robótica no Câncer de Pâncreas
As ressecções pancreáticas esquerdas e da cabeça do pâncreas devem ser consideradas separadamente. Para ressecções esquerdas em técnica laparoscópica, o estudo randomizado controlado LEOPARD mostrou recuperação mais rápida, menos perda de sangue e nenhuma taxa de complicação mais alta em comparação com a técnica aberta [30]. A análise combinada dos estudos LEOPARD e LAPOPS confirmou os dados [31]. A qualidade de vida a longo prazo permanece inalterada com a técnica laparoscópica [32]. Uma meta-análise dos dados existentes mostrou resultados comparáveis para a taxa de ressecção R0 e a taxa de quimioterapia adjuvante [33]. A sobrevivência global mediana foi a mesma para ressecções pancreáticas esquerdas laparoscópicas e abertas em 28 e 31 meses, respectivamente [34].
Para ressecções da cabeça do pâncreas, o estudo randomizado e controlado LEOPARD-2 publicado em 2019 mostrou maior mortalidade (mortalidade em 90 dias de 10%) no grupo laparoscópico, que não teve vantagens sobre o grupo aberto em termos de dor pós-operatória, recuperação, internação hospitalar e qualidade de vida [36]. Um estudo randomizado chinês recente mostrou mortalidade comparável na ressecção laparoscópica da cabeça do pâncreas com apenas uma ligeira vantagem da técnica laparoscópica [37].
A robótica também se estabeleceu na cirurgia pancreática nos últimos 10 anos. Além da ressecção esquerda tecnicamente mais simples, a pancreaticoduodenectomia está sendo realizada cada vez mais. No entanto, é necessária uma longa curva de aprendizado [37], e uma avaliação final em relação aos resultados oncológicos ainda não é possível. Apenas estudos observacionais estão disponíveis sobre o uso da robótica para indicações malignas, demonstrando viabilidade e potenciais vantagens da técnica minimamente invasiva [38, 39, 40]. De acordo com as diretrizes internacionais, uma indicação maligna não é uma contraindicação fundamental para a robótica, mas resultados de ensaios randomizados controlados e, portanto, resultados de alta qualidade não são esperados por mais 3 a 5 anos [41].
Centralização da Cirurgia Pancreática
Em centros de alto volume para cirurgia pancreática, a mortalidade pós-operatória pode ser reduzida e a sobrevivência aumentada [42, 43, 44]. Contra esse pano de fundo, os volumes mínimos para procedimentos pancreáticos complexos na Alemanha serão aumentados dos atuais 10 para 20 ressecções por ano a partir de 2024, conforme decidido pelo Comitê Federal Conjunto.
Procedimento de Whipple versus Pancreatoduodenectomia com Preservação do Piloro (PPPD)
Dois procedimentos cirúrgicos são considerados para a ressecção de carcinomas da cabeça do pâncreas e periampulares, a ressecção clássica de acordo com Kausch-Whipple e a pancreatoduodenectomia com preservação do piloro. Esta última tem a vantagem de preservar a passagem fisiológica dos alimentos e reduzir síndromes de dumping, perda de peso pós-operatória e refluxo [45-52].
Estudos mais recentes [49, 51, 52] mostraram uma taxa de transfusão e internação hospitalar mais baixa para pacientes PPPD em comparação com o grupo Whipple. A morbidade pós-operatória não diferiu significativamente entre os dois grupos. A ocorrência de distúrbios de esvaziamento gástrico foi comparável em ambos os grupos (Whipple 23% vs. PPPD 22%). Também não houve diferença significativa na radicalidade cirúrgica (R0-Whipple 82.6% vs. R0-PPPD 73.6%). O acompanhamento a longo prazo mostrou taxas de sobrevivência global comparáveis.