Ösophagus
Allgemeine Merkmale
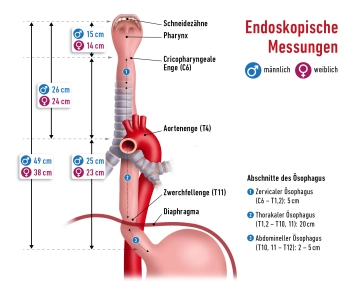
- Muskulärer Hohlorgan, ca. 25–30 cm lang
- Verbindet Pharynx (C6) mit dem Magen (Th11)
- Drei Engstellen:
- Obere Engstelle – Ringknorpelenge (Übergang Pharynx/Ösophagus, auf Höhe C6)
- Mittlere Engstelle – Aortenenge (Kreuzung mit Aortenbogen + linker Hauptbronchus)
- Untere Engstelle – Zwerchfellenge (Hiatus oesophageus, Th10)
Topographische Abschnitte
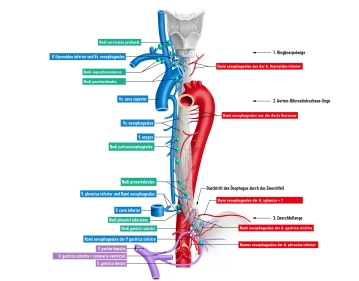
Zervikaler Ösophagus (C6–Th1)
- Hinter der Trachea
- Begleitstruktur: N. laryngeus recurrens
- Zugang: transzervikal, ventral-lateral
Thorakaler Ösophagus (Th1–Th10)
- Oberes Mediastinum: hinter Trachea, vor Wirbelsäule
- Mittleres Mediastinum: hinter Herz und Perikard
- Kreuzung durch Aortenbogen, V. azygos, linker Hauptbronchus
- Zugang: rechts-thorakal (bessere Übersicht)
Abdominaler Ösophagus (kurz, 1-3 cm)
- Tritt durch Hiatus oesophageus (Th10) ins Abdomen
- Mündet in den Cardia-Bereich des Magens
- Begleitstrukturen: Truncus vagalis anterior (links), posterior (rechts)
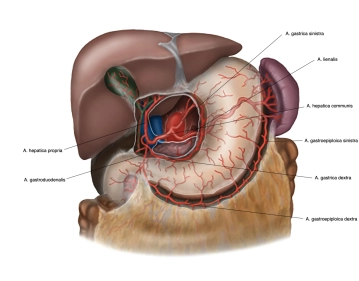
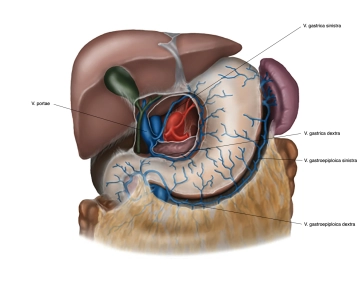
Magen
Allgemeines & Lage
- Muskuläres Hohlorgan zwischen Ösophagus und Duodenum
- Liegt im linken/mittleren Oberbauch, direkt unter dem Zwerchfell
- Lässt sich in Größe und Form je nach Alter, Füllungszustand und Körperlage stark variieren
- Interindividuell große Unterschiede hinsichtlich Lage, Größe und Form
- Liegt intraperitoneal; überwiegend mit Serosa überzogen (außer dorsale Cardia)
Größe & Füllvermögen
- Durchschnittliche Länge: 25–30 cm (bei mäßiger Füllung)
- Speicherkapazität: ca. 1,5 Liter, im Extremfall bis zu 2,5 Liter
Befestigung
- Embryonale Mesogastrien drehen sich in eine frontale Position:
- Omentum minus: von der kleinen Kurvatur zur Leberpforte
- Omentum majus: von der großen Kurvatur zum Querkolon, Milz und Zwerchfell
- Befestigung und Stabilisierung durch Bänder, die unter anderem zur Leber und Milz ziehen
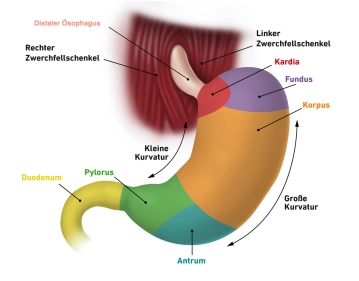
Abschnitte des Magens
- Cardia (Mageneingang, oberer Magenmund, Ostium cardiacum)
- Bereich von 1–2 cm, in dem die Speiseröhre in den Magen mündet
- Markanter Übergang von Speiseröhrenschleimhaut zu Magenschleimhaut (gut sichtbar bei Endoskopie)
- Fundus gastricus (Magengrund)
- Befindet sich oberhalb des Mageneingangs, wölbt sich nach oben
- Auch als Magenkuppel oder Fornix gastricus bezeichnet
- Typischerweise mit Luft gefüllt; im aufrechten Zustand höchster Punkt, erkennbar als „Magenblase“ im Röntgenbild
- Abgegrenzt gegenüber dem Mageneingang durch die Incisura cardialis
- Corpus gastricum (Magenkörper)
- Hauptteil des Magens
- Ausgeprägt durch tiefe Schleimhautlängsfalten (Plicae gastricae), die vom Mageneingang bis zum Pylorus verlaufen („Magenstraße“)
- Pylorus (Pars pylorica, Magenpförtner)
- Beginnend mit dem erweiterten Antrum pyloricum, gefolgt von Pförtnerkanal (Canalis pyloricus)
- Endet mit dem eigentlichen Magenpförtner (Pylorus), wo der Magenschließmuskel (M. sphincter pylori) angesiedelt ist
- Verschließt den Magenausgang (Ostium pyloricum) und reguliert die Passage des Chymus ins Duodenum
Weitere anatomische Kennzeichen
- Große Kurvatur (konvexe Seite)
- Kleine Kurvatur (konkave Seite)
- Vorderwand: Paries anterior; Hinterwand: Paries posterior